2017年5月1日,FDA加速批准阿斯利康旗下的PD-L1抗体药物Durvalumab,商品名为Imfinzi,,用于治疗在完成或进行以铂为基础的标准方案治疗后出现疾病进展的局部晚期或转移性尿路上皮癌(UC)患者。Imfinzi由此成为阿斯利康首个获批的生物制品申请(BLA)。

Imfinzi成为继罗氏Tecentriq、辉瑞/默克Bavencio之后第3个PD-L1抗体药物。Tecentriq、Imfinzi均采用低ADCC活性的设计,Tecentriq通过Fc-engineering 去除糖基化,Imfinzi直接采用低ADCC活性的IgG4亚型,只有Bavencio采用强ADCC活性的IgG1亚型。
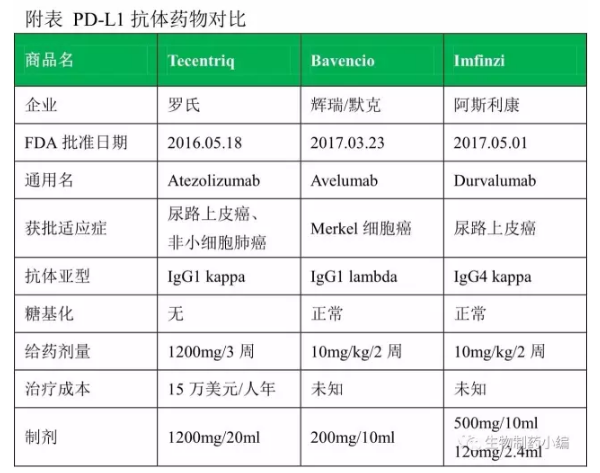
目前PD-1/PD-L1领域已经有5个抗体药物:
Opdivo:转移性黑色素瘤、非小细胞肺癌、晚期肾细胞癌、霍奇金淋巴瘤、头颈癌、尿路上皮癌;
Keytruda:晚期黑色素瘤、转移性黑色素瘤、非小细胞肺癌、头颈癌;
Tecentriq:尿路上皮癌、非小细胞肺癌;
Bavencio:Merkel细胞癌;
Imfinzi:尿路上皮癌。
2016年,PD-1/PD-L1靶点的3个药物Opdivo、Keytruda、Tecentriq合计销售额达60亿美元,首个药物上市3年后迅速成长为仅次于TNF-α、VEGF/VEGFR、HER2、CD20的第五大抗体药物靶点。其中Opdivo即实现46亿美元销售额,日本市场因非小细胞肺癌获批即迅速达到9亿美元规模。
阿斯利康在2007年以152亿美元收购MedImmune获得Durvalumab,随着Durvalumab的获批,阿斯利康在抗体领域的地位将逐步得到加强。







