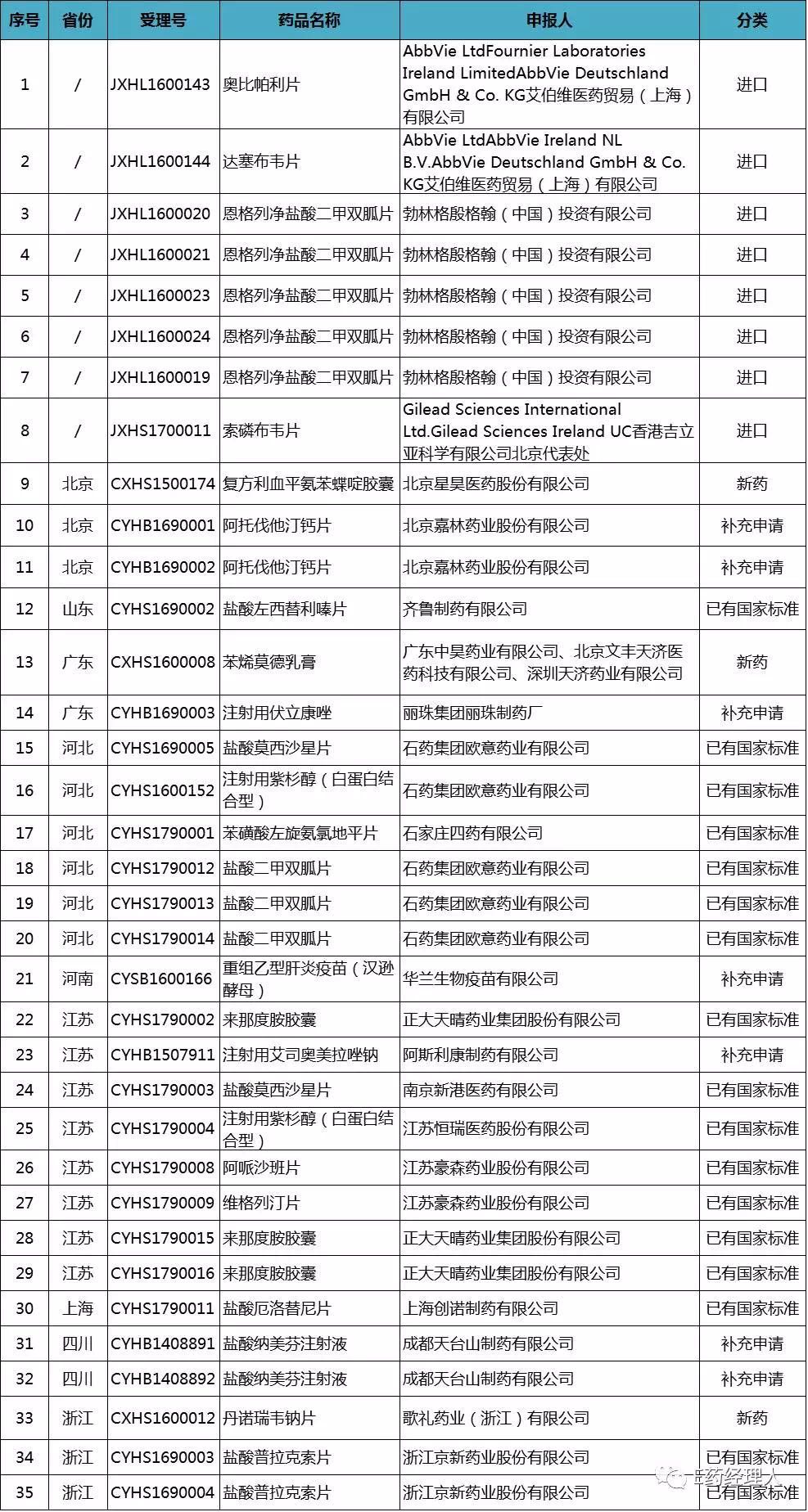
4月13日,CFDA发布公告称,决定对新收到35个已完成临床试验申报生产或进口的药品注册申请进行临床试验数据核查。本次核查涉及恒瑞、豪森、石药、齐鲁、歌礼、艾伯维、吉列德、阿斯利康等国内外共22家制药企业。
在CFDA组织核查前,申请人自查发现问题主动撤回的,将不追究责任;现场核查计划公布10日后将不接受撤回申请,一旦发现数据造假,申请人、药物临床试验责任人和管理人、合同研究组织责任人将从重处理,并追究未能有效履职的核查人员责任。
就在3天前,CFDA再发《关于药物临床试验数据核查有关问题处理意见的公告(征求意见稿)》,明确给出判定造假的具体七条标准,以及临床试验中的黑名单制度,申请人的法定代表人以及在药品注册申报资料上署名的相关责任人将被直接追责。
35个药物临床试验数据自查核查注册申请清单