为加强医疗器械产品注册工作的监督和指导,进一步提高注册审查质量,国家食品药品监督管理总局组织制定了胎儿染色体非整倍体(T21、T18、T13)检测试剂盒(高通量测序法)注册技术审查指导原则。
本指导原则旨在指导注册申请人对胎儿染色体非整倍体(T21、T18、T13)检测试剂盒(高通量测序法)注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。
本指导原则是针对该类试剂的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
本指导原则是对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但需要详细阐明理由,并对其科学合理性进行验证,提供详细的研究资料和验证资料,相关人员应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则相关内容也将适时进行调整。
一、范围
胎儿染色体非整倍体(Fetal Chromosome?Aneuploidies)中的 21 三体、18 三体、13 三体(Trisomies 21、Trisomies 18、Trisomies13,即 T21、T18、T13)是临床上最常见的染色体非整倍体疾病。其对应的分别为 21- 三体综合征(又称唐氏综合征,先天愚型或 Down 综合征)、18- 三体综合征(又称 Edwards 综合征)和 13- 三体综合征(又称 Patau 综合征),发病率分别约为 1 /700、1/6000、1/10000,患儿绝大多数存在严重智力障碍及器官畸形。
产前筛查和产前诊断是为避免产生遗传缺陷患儿提供的手段。常规的产前筛查方法包括:早孕期的超声与血清学联合筛查和中孕期母体血清学筛查。筛查结果为高风险的孕妇经建议经产前诊断进行最终确认,由孕妇知情选择。胎儿染色体异常的产前诊断金标准为介入前产前诊断手术,是指通过绒毛取材术 / 羊膜腔穿刺术 / 经皮脐血管穿刺术,取相应细胞采用细胞生物学方法对胎儿染色体进行核型分析。
高通量测序方法检测胎儿染色体非整倍体的原理是:孕妇母体血浆中存在胎儿游离 DNA(cell-free DNA,cfDNA),长度约为 75bp—250bp,几乎全部来源于胎盘的滋养层细胞,其浓度和孕周密切相关并以一定比例(5%—30%)稳定存在于母体外周血浆中。高通量测序方法通过取母体血浆提取包含正常母体和胎儿的血浆游离 DNA,经文库构建,片段扩增等,最后进行上机测序,通过软件分析数据获得染色体数目评价结果。以检测 21 三体综合征为例,当对怀有 T21 胎儿的母体血浆游离 DNA 数据进行分析时,其 21 号染色体游离 DNA 总数会有小比例的升高,通过统计学算法区分这一微小差异来实现利用 cfDNA 进行胎儿染色体非整倍体的产前筛查。但高通量测序法不能对染色体结构异常进行检测,不能代替传统筛查中的开放式神经管缺陷筛查等。
本指导原则所述的胎儿染色体非整倍体(T21、T18、T13)检测试剂盒(高通量测序法)是指通过高通量测序法检测孕妇外周血血浆中胎儿游离脱氧核糖核酸(DNA),通过分析样本中的胎儿游离 DNA 的 21 号、18 号及 13 号染色体数量的差异,预期用于对胎儿染色体非整倍体疾病 21- 三体综合征、18- 三体综合征和 13- 三体综合征进行产前筛查的检测试剂盒。
本指导原则所述的高通量测序法,是指通过文库构建、片段扩增进而进行上机测序的第二代测序方法,不需要进行片段扩增的第三代、第四代单分子测序方法在文中并未涉及。但高通量测序技术发展迅速,第三代、第四代单分子测序方法在企业内部参考品设置、性能评估或临床评价等处如有适用的方面,可以参照执行。
本指导原则所述检测试剂盒的适用人群为:对孕周为 12+ 0 周及以上的孕妇进行产前筛查,其结果不能代表对孕妇怀有三体胎儿的确认,产前筛查的结果必须要经过产前诊断进行确认。
伦理学原则应遵守国家相关法律法规及行业规定。
二、注册申报资料要求
(一)综述资料
综述资料主要包括产品预期用途、产品描述、有关生物安全性的说明、有关产品主要研究结果的总结和评价以及其他内容。其中,其他内容包括同类产品在国内外批准上市的情况,应着重从方法学及检出限等方面写明拟申报产品与目前市场上已获批准的同类产品之间的主要区别。综述资料应符合《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第 5 号,以下简称《办法》)和《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局公告 2014 年第 44 号,以下简称“公告”)的相关要求。
综述资料应详细阐明检测原理,可配合图示并写明一个完整检测配合使用的全部试剂及耗材名称、生产厂家、货号或注册证书号以及详细的组成成分。
(二)主要原材料的研究资料
主要原材料的研究资料包括企业内部参考品和完成检测所需试剂组成两部分。
1. 企业内部参考品应至少包括:阳性参考品、阴性参考品、检测限参考品、嵌合体参考品,具体要求如下:
1.1 阳性参考品:应采用 T21、T18、T13 胎儿 DNA 片段按一定比例与正常女性血浆混合的模拟样本。
1.2 阴性参考品:应包括采用染色体数目正常胎儿 DNA 片段按一定比例与正常女性血浆混合的模拟样本,以及采用其他染色体异常胎儿 DNA 片段按一定比例与正常女性血浆混合的模拟样本。其他染色体异常的阴性参考品由申请人依据常见染色体异常项目并根据对产品的质控要求自行选择。
1.3 检测限参考品:应采用 T21、T18、T13 胎儿 DNA 片段按不同比例梯度与正常女性血浆混合的模拟样本,如 5%、3.5%、2.5% 等,建议采用 95%(n≥20)的阳性检出率作为最低检测限确定的标准。
1.4 嵌合体参考品:由申请人按照对产品的质控要求自行设定模拟 T21、T18 和 T13 嵌合体的组成比例,如 70% 异常,30% 正常;30% 异常,70% 正常等。
T21、T18、T13 及其他染色体异常胎儿 DNA 片段可由流产组织或羊水细胞、细胞系等来源制备。
申请人应详细说明企业内部参考品的组成、详细说明制备及检定方法、胎儿 DNA 片段浓度确认方式和所占比例的选择依据。组成各项企业内部参考品的样本应为不同来源。
2. 完成全部检测流程所需试剂一般应至少包括:血浆游离 DNA 提取纯化试剂、文库构建试剂、文库定量试剂、测序试剂、阴性质控品、阳性质控品以及与之配合使用的测序芯片和数据分析软件。具体要求如下:
2.1 血浆游离 DNA 提取纯化试剂:无论申报产品中是否包含,申请人均应提交配合使用的提取纯化试剂的原理、详细组成成分、生产厂家、货号及第一类医疗器械备案凭证编号的相关资料。性能方面需对该试剂提取的 DNA 片段长度范围准确性及纯度要求,提取效率、重复性及抗干扰能力进行评估。
2.2 文库构建试剂、文库定量试剂、测序试剂:文库构建试剂对片段化的 DNA 进行缺口补平及相应部分 5‘端磷酸化(如需)和 3’端去磷酸化(如需),之后使用连接酶加上用于测序和分析的标签和接头,构建成可以用来测序上机的标准文库;文库定量试剂通过 PCR 扩增及与标准品曲线的比对,用于定量测定文库浓度,为后续均一化文库进行上机测序做准备,同时能够评估文库构建的质量。文库定量时应明确对文库质量、片段大小及浓度要求,应提供分析图谱,对其中参数进行解释说明(如是否有杂峰,产生的原因,是否对最终结果产生影响等)。文库定量不限于上述方法,也可采用其他方法进行,如荧光染料法、Qubit 定量等;测序试剂用于对均一化的文库进行片段扩增,通过基因测序仪捕捉扩增过程中碱基的变化引起的信号变化来达到读取序列的目的。
以上三种试剂一般由:相应功能的酶(末端修复酶、DNA 连接酶、缺口修复酶 DNA 聚合酶等)、核苷酸序列(引物、接头序列、标签序列、文库定量标准品)、缓冲液及 dNTP 组成。具体要求如下:
2.2.1 酶:应提交纯度、活性及功能性试验资料。例如:文库构建过程包括但不限于末端修复酶、DNA 连接酶、缺口修复聚合酶等,所选择的酶应当具有末端突出削平、缺口补平、标签或接头连接、DNA 聚合酶活性。
2.2.2 核苷酸序列:应提交相应的序列组成和纯度信息,序列准确度;引物设计应提交引物设计原则及选择对比依据。
2.2.3 缓冲液:应明确详细的组成及各盐浓度选择对比的依据。
2.2.4 dNTP:包括 dATP、dGTP、dCTP、dTTP,应提交对纯度、浓度等的详细验证资料。
2.3 阴、阳性质控品:须能够监控 DNA 片段提取到最终测序结果全过程,因此应当由阴、阳性(T21、T18 和 T13)胎儿 DNA 片段按已知比例与正常女性血浆基质混合组成。
2.4 测序芯片:应详细阐明芯片进行片段扩增的原理及结构,明确使用芯片型号,并对同一次测序芯片上样的样本间精密度进行评价。
2.5 数据分析软件:举例介绍原始数据质量评估、数据处理和筛选的方法,明确数据筛选依据以及使用的算法。
2.6 提交不同原材料对于最终测序数据质量影响的评估材料。由于各测序平台的技术侧重点不同,数据质量评估的项目可能存在差异,需考虑包括但不限于以下方面:文库浓度、文库片段大小、单样本总序列数(数据量)、唯一比对率、单次检测的 GC gap(最高 GC 值与最低 GC 值的差值)等。
2.7 除上述资料,申请人还应提交主要原材料的筛选依据及试验资料。如为自制,则应提交:制备方法、质量要求、质量检测方法、对比筛选的试验资料等;如为外购,则应提交:外购证书、质量要求、质量检测方法、对比筛选的试验资料等。其中,对比筛选的试验资料应包括筛选过程中的数据、图谱、对比图表等信息。
(三)主要生产工艺及反应体系的研究资料
1. 主要生产工艺包括配制工作液、半成品检定、分装和包装。配制工作液的各种原材料及其配比应符合要求,原材料应混合均匀,配制过程应对关键参数进行有效控制。所提交申报资料中应包括主要生产工艺介绍和生产工艺流程图,后者需标明关键工艺质控步骤,并详细说明该步骤的质控方法及质控标准。
2. 反应体系研究指完成检测所涉及到的最佳反应条件的选择确定过程,包括对提取纯化步骤、游离 DNA 片段的末端修复、接头及标签连接、文库定量、片段扩增、测序反应的反应条件及反应体系的选择确定,涉及到对样本类型、样本用量、试剂用量、缓冲体系的选择、反应温度和时间条件及检测过程中质控方法确定的依据。重点关注:酶浓度、引物浓度、dNTP 浓度、离子浓度、加样量及反应体积、片段扩增各阶段温度、时间及循环数、测序数据质量的评估指标等,其中加样量和反应体积应参考相应行业标准,经研究验证后确定。
此外,还应对数据量及胎儿游离 DNA 浓度和比例对检测结果的影响进行研究。
(四)分析性能评估资料
申请人应提交产品在产品研制或成品验证阶段对试剂盒进行的全部性能的评估资料,对于每项分析性能的评价都应包括研究目的、实验设计、研究方法、可接受标准、实验数据、统计方法等详细资料。有关分析性能评估的背景信息也应在申报资料中有所体现,包括实验地点(实验室)、人员及数量、适用仪器、试剂规格、批号、临床样本来源(如涉及)等。分析性能评估的实验方法可以参考相关的美国临床实验室标准化协会批准指南(CLSI-EP)文件或国内有关体外诊断产品性能评估的指导原则进行。建议着重对以下分析性能进行研究:
1. 最低检出限:建议使用企业参考品进行梯度稀释并多次检测,将具有 95% 阳性检出率的胎儿游离 DNA 浓度水平作为最低检出限。企业参考品应使用公认的准确定量方法进行,最低检出限应描述为 XX DNA 浓度下可检出胎儿 DNA 的最小百分比。
2. 企业内部参考品符合率:对试剂检测企业内部参考品的符合情况进行评估。
3. 精密度:精密度的评价方法并无统一的标准可依,可根据不同产品特征或企业的研究习惯进行,前提是必须保证研究的科学合理性,具体实验方法可以参考相关的美国临床实验室标准化协会批准指南(CLSI-EP)或国内有关体外诊断产品性能评估的指导原则进行。企业应对每项精密度指标的评价标准做出合理要求,如标准差或变异系数的范围等。针对本类产品的精密度评价主要包括以下要求:
3.1 对可能影响检测精密度的主要变量进行验证,除检测试剂(包括核酸分离 / 纯化组分)本身的影响外,应对高通量基因测序仪、操作者、地点、合理的精密度评价周期等要素进行相关的验证。
例如:为期至少 XX 天的连续检测,每天至少由 2 人完成不少于 2 次的完整检测,从而对批内 / 批间、日内 / 日间以及不同操作者之间的精密度进行综合评价。申请人还应选择不同的实验室进行重复实验以对室间精密度进行评价。
3.2 用于精密度评价的模拟样品和临床样本均应至少包含 3 个水平:阴性样品、临界阳性样品、(中或强)阳性样品,并根据产品特性设定适当的精密度要求。精密度评价中的每一次检测均应从核酸提取开始。
4. 干扰试验:包括内源性干扰物质和外源性干扰物质。应针对可能存在的干扰情况进行验证。建议申请人在干扰物质的潜在最大浓度(即“最差条件”)条件下进行评价。内源性干扰物质的评价至少应包括胆红素、游离血红蛋白、甘油三酯。
5. 特异性:对以下是否干扰 T21、T18、T13 阴阳性的检出能力进行评价:
5.1 微缺失、微重复评价:申请人应采用一定比例的微缺失、微重复胎儿 DNA 与正常女性血浆混合制备微缺失、微重复模拟样本进行评价。
5.2 嵌合体评价:申请人应采用不同嵌合比例的模拟 T21、T18 和 T13 嵌合体样本对试剂检测嵌合体的能力进行评估,对不能检测到的模拟嵌合体的嵌合比例进行确认。
5.3 对其他常见染色体样本的干扰进行评价。
微缺失微重复模拟样本、嵌合体模拟样本及其他常见染色体样本的类型和数量由申请人选择确定,并在产品说明书中明确。
(五)阳性判断值的确定资料
由于目前胎儿染色体非整倍体 T13、T18、T21 的阳性判断值存在多种计算方式,且更好的算法和数据处理方式仍在不断开发中。因此,如申请人选择了某一算法作为阳性判断值的计算方式,则应详细阐述选择该算法作为阳性判断值依据的原因(如权威文献、行业共识等),并详细阐述计算公式和各参数代表的意义。
以大样本量常用的 Z - 值(Z-score)算法来举例说明:
1.Z- 值这个统计量反应的是当前数值距离平均数的相对标准距离,Z- 值的应用条件为大样本量以及数据符合正态分布,计算公式如下:
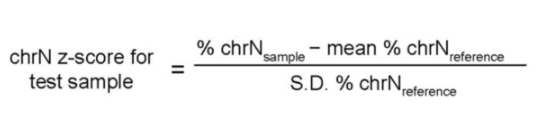
1.1chrN z-score for test sample: 所检测样本的 Z - 值;
1.2 N:指定的第 N 染色体;
1.3%chrNsample:待测样品第 N 条染色体唯一比对序列数占常染色体的百分比,通过高通量测序后软件分析获得;
1.4 Mean%chrNreference:参照样品第 N 条染色体比例平均值;
1.5S.D.%chrNreference:参照样品第 N 条染色体比例的标准偏差。
该公式中,影响唯一比对序列的因素包括 GC 含量、检验覆盖度等,申请人应计算并统计检验覆盖度是否在正常范围内。参照样品的数量、来源等均对其数据产生影响,进而影响 Mean%chrNreference 和 S.D.%chrNreference。因此,申请人需对参照样品的数据计算进行详述,并提供计算值。
2. 被筛查孕妇所怀胎儿的染色体数量状况符合正态分布,即大概率为正常染色体数量,小概率事件为胎儿染色体非整倍体,如图 1 所示:
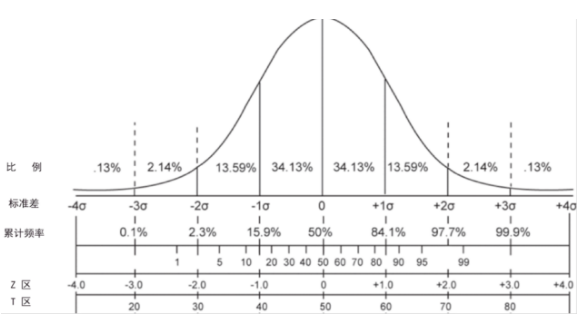
如图 1 可以看出,出现在 Z - 值为正负 3 以外的数值,则有 99.9% 的可能为阳性,因此,通常将 Z - 值 = 3 定为阳性判断值分界点,Z- 值 >3 或 Z - 值 <- 3 判断为胎儿染色体非整倍体阳性。?申请人应当根据试验对 z - 值 >3 及 Z - 值 <- 3 的情况分别进行说明。<>
鉴于并无 100% 阴阳性分界点,一般来说,申请人应设定阳性判断值灰区范围,灰区的设定应提交理论和实际试验结果的依据,并在说明书【阳性判断值】和【检验结果的解释】项进行解释说明,如:是否需要用产前诊断的方式进行最终确认,可能的原因,是否需要孕龄再大时进行再次抽血复测等等。如无灰区设置,也应提交理论和大样本量试验结果的依据。
在阳性判断值设定后,申请人应当选取一定数量阴、阳性真实临床样本进行试验验证,如与该公式不符,则应说明出现的问题及详细的数据校正方式。
(六)稳定性研究资料
稳定性研究资料应包括研究方法的确定依据、具体的实施方案、详细的研究数据以及结论。主要涉及两部分内容,申报产品的稳定性和适用样本的稳定性研究。
1. 申报产品的稳定性研究主要包括实时稳定性(有效期)、运输稳定性、开瓶稳定性及冻融次数限制等研究。对于实时稳定性研究,应提供至少三批样品在实际储存条件下保存至成品有效期后的研究资料。
2. 适用样本的稳定性研究主要包括对含有游离 DNA 的孕妇血浆的保存、冷藏和冷冻条件下的有效期验证以及血浆游离 DNA 提取后储存条件的验证。可以在合理的温度范围内选择温度点(温度范围),每间隔一定的时间段对储存样本进行检测,从而确认样本的稳定性。适于冷冻保存的样本还应对冻融次数进行评价。
应注意运输稳定性、开瓶稳定性等研究实际上均指经运输或开瓶后对产品效期及检测性能是否有影响,因此申请人应在试验设计中充分考虑上述因素。此外,产品稳定性和样本稳定性两部分内容的研究结果均应在说明书【储存条件及有效期】和【样本要求】两项中进行详细说明。
(七)产品技术要求
拟定产品技术要求应符合《办法》、“公告”和《医疗器械产品技术要求编写指导原则》(国家食品药品监督管理总局通告 2014 年第 9 号)的相关要求。
如果拟申报试剂已有相应的国家 / 行业标准发布,则企业标准的要求不得低于上述标准要求。
(八)产品注册检验报告
根据总局第 5 号令要求,首次申请注册的第三类产品应在国家食品药品监督管理局认可的、具有相应承检范围的医疗器械检测机构进行连续三个生产批次样品的注册检验。该产品已有国家参考品发布,在注册检验时应使用“高通量测序用外周血胎儿染色体非整倍体(T21、T18 和 T13)国家参考品”进行。
(九)产品说明书
产品说明书的格式应符合《体外诊断试剂说明书编写指导原则》(国家食品药品监督管理总局通告 2014 年第 17 号)的要求,进口产品的中文说明书除格式要求外,其内容应尽量保持与原文说明书的一致性,翻译力求准确且符合中文表达习惯。产品说明书的所有内容均应与申请人提交的注册申报资料中的相关研究结果保持一致,如某些内容引用自参考文献,则应以规范格式对此内容进行标注,并单独列明参考文献的相关信息。
结合《体外诊断试剂说明书编写指导原则》的要求,下面对说明书的重点内容进行详细说明。
1.【产品名称】
建议按照如下方式命名:胎儿染色体非整倍体(T21、T18、T13)检测试剂盒(方法学)或胎儿染色体非整倍体(T21/T18/T13)检测试剂盒(方法学)。
举例:胎儿染色体非整倍体(T21、T18、T13)检测试剂盒(半导体测序法)、胎儿染色体非整倍体(T21/T18/T13)检测试剂盒(可逆末端终止测序法)。
2.【预期用途】
2.1 第一自然段:预期用途描述,包括被测孕妇孕周特征,样本类型等。
举例:该产品用于定性检测孕周为 12+ 0 周及以上的孕妇外周血血浆中胎儿游离脱氧核糖核酸(DNA),通过分析样本中的胎儿游离 DNA 的 21 号、18 号及 13 号染色体数量的差异,对胎儿染色体非整倍体疾病 21- 三体综合征、18- 三体综合征和 13- 三体综合征进行产前筛查。如试剂盒仅是测序步骤中的建库步骤,则预期用途应描述为“构建测序文库”。
2.2 第二自然段:按照《体外诊断试剂说明书编写指导原则》介绍临床适应症及背景,说明相关的临床或实验室诊断方法等,应介绍产前诊断金标准。
2.3 第三自然段:明确该产品仅作为 21 号、18 号及 13 号染色体的产前筛查用途,其结果要由产前诊断金标准进行确认并遵守相关法律法规及行业规范。
3.【检验原理】
详细说明该产品检测母体胎儿游离 DNA 判断染色体数量的检测原理及方法学原理(必要时可用图示进行)。
4.【主要组成成分】
说明试剂盒所包含组分的名称、数量、比例或浓度等信息,说明不同批号试剂盒中各组分是否可以互换。
试剂盒中不包含但该项检测必需的组分,说明书中应列出相关试剂 / 耗材的名称、生产企业、货号、注册证号 / 第一类医疗器械备案凭证编号(如有)及其他相关信息,测序芯片应明确型号。
5.【储存条件及有效期】
5.1 按照稳定性研究资料,说明试剂盒的效期稳定性、开瓶稳定性、复溶稳定性、运输稳定性、冻融次数要求等,应标明具体的储存条件及效期。
5.2 按照《医疗器械说明书和标签管理规定》(总局令第 5 号)增加生产日期,使用期限或者失效日期。
6.【样本要求】
6.1 样本采集要求。
6.2 说明对采血管及抗凝剂的要求。
6.3 样本保存、运输及处理:孕妇外周血样本的保存条件(温度、保质期限)、运输条件、处理条件(如:多长时间内必须分离血浆);已分离的血浆样本的保存条件(温度、保质期限)、运输条件、处理条件(如:核酸提取前的预处理);冷藏 / 冷冻样本检测前是否需恢复至室温,冻融次数的要求。
上述内容均需在稳定性研究资料中详述并用产品进行性能评估验证。
7.【适用机型】
适用的测序仪器具体型号,并提供与仪器有关的重要信息以指导用户操作。
8.【检验方法】
无论是否包含提取试剂或测序试剂,申请人应从头详细描述完成完整检测所需的全部步骤以指导用户正确操作,包括血浆游离 DNA 的提取、文库构建、文库定量、片段扩增及上机测序。该类产品操作程序较多,作为产品使用说明书该项内容应当尽量详细,以能够指导用户进行操作,其中应当包括各步骤的注意事项及配合使用物品的技术参数、仪器厂家和型号(如 PCR 仪,生物分析仪等)和反应条件,以半导体测序为例:
8.1 DNA 提取:DNA 提取方式、提取试剂盒货号及第一类医疗器械备案凭证编号;DNA 提取液的短期和长期保存方式、冻融次数等。
8.2 文库构建:末端修复、接头连接、缺口修复、PCR 扩增;所构建的文库短期和长期保存方式,冻融次数等。
8.3 文库定量;描述对于定量后文库浓度和质量的要求,以及何种情况进行文库的重新构建。
8.4 测序模板的制备:混合文库、PCR、模板富集。
8.5 上机测序:仪器准备、设置及仪器使用相关参数。
9.【阳性判断值】
明确设定阳性判断值所使用的算法及验证参考值所使用的样本例数及类型。如使用软件,则应明确软件名称、唯一标识号、生产厂家及医疗器械注册证书编号;如暂未取得医疗器械注册证书,应空出相应内容,在软件名称后注明(医疗器械注册证书编号:)。
10.【检验方法的局限性】
10.1 本试剂盒作为胎儿染色体非整倍体筛查检测,其结果仅供临床参考,不能作为诊断的唯一依据。对患者的临床诊断应采用金标准方法(染色体核型分析)并结合其症状 / 体征、病史及其他实验室检查等情况综合进行。本试剂盒不能对胎儿染色体结构异常进行检测。
10.2 本试剂盒适用于孕妇外周血血浆样本检测,不适用于其它样本检测。
10.3 胎儿游离 DNA 浓度在孕妇外周血中存在较大个体差异,变化范围从 2% 到 30% 不等且和孕周密切相关,因此若因胎儿游离 DNA 浓度较低造成检验失败时,可待孕周较大时再次抽血检测。
10.4 以下几种情况的孕妇样品可能会出现假阳性或假阴性结果,需要结合其他检测结果进行综合判断:
10.4.1 孕妇本人为染色体非整倍体疾病患者、其他染色体疾病患者或携带者;
10.4.2 胎儿染色体异常中的平衡易位、嵌合型三体异常;
10.4.3 怀有双胎或者多胎(三胎及三胎以上)的孕妇;
10.4.4 近期接受过移植手术、干细胞治疗;近期接受过免疫治疗或输注过异体血制品;
10.4.5 孕妇本人为肿瘤患者;
10.4.6 通过体外受精—胚胎移植(IVF-ET)方式受孕的孕妇;
10.4.7 体重严重超重的孕妇。
10.5 样本采集、运输及处理不当、未按说明书操作均有可能导致假阳性或假阴性结果;描述在样本采集,保存、运输中需遵循的原则及注意事项,例如:
10.5.1 描述适用的抗凝采血管;
10.5.2 颠倒混匀时动作应轻柔,防止溶血;
10.5.3 全血离体后须进行血浆分离的时间;
10.5.4 血浆分离过程中注意不要吸到中间层的白细胞;
10.5.5 血浆样本是否能够进行反复冻融;
10.5.6 禁止将 XX 抗凝样本和血浆样本在室温状态下放置;
10.5.7 血浆样本寄送采用的运输保存方式。
10.6 其他局限性。
11.【产品性能指标】
按照分析性能评估资料内容详述以下性能指标:最低检出限、企业内部参考品符合率、精密度、干扰试验、特异性。各项评估应包括评估方法、数据和结果。应将临床评价的试验结果纳入,包括临床试验机构数量、样本例数、试验结果等内容。
(十)临床评价资料
1. 研究方法
对照方法:依据卫生部(现国家卫生与计划生育委员会)发布的“《WS322.2-2010 胎儿染色体异常与开放性神经管缺陷的产前筛查与诊断技术标准》第 2 部分:胎儿常见染色体异常的细胞遗传学产前诊断技术标准”,以介入性产前诊断手术结果(包括绒毛取材术、羊膜腔穿刺术和经皮脐血管穿刺术)和出生随访结果作为确诊胎儿染色体非整倍体 T21、T18、T13 的对照金标准。对于出生随访,应在方案中明确随访由新生儿医师进行,各机构在制定方案中对医师进行统一的培训,采用科学的、统一的评价标准和评价项目(应当提供依据)对出生后婴儿表观进行是否是三体患儿的诊断,也可采用出生后采血进行核型分析的方式进行诊断。
研究方法为前瞻性研究,是指对临床需要正常进行产前诊断的孕妇采集样本与金标准检测进行对比分析。
统计学分析一般选用交叉四格表的形式总结本试剂盒测序结果和金标准检测结果并进行卡方或 kappa 检验,与金标准比对进行敏感性、特异性分析,计算阳性预测值、阴性预测值。对于以上统计值,均应做统计假设,并报告 95% 置信区间。
2. 临床研究机构及人员
临床研究机构应为已取得产前诊断技术服务资质的医疗机构。人员应为经过专门培训的取得资质的人员。机构和人员应遵循《产前诊断技术管理办法》《母婴保健专项技术服务许可及人员资格管理办法》,机构取得《母婴保健技术服务执业许可证》,人员取得《母婴保健技术考核合格证书》。
3. 适用人群及样本量
适用人群为孕周为 12+ 0 周及以上的孕妇。不同年龄段孕妇应按自然比例分布,35 岁及以上孕妇占比应控制在 10%—15%。样本量依据统计学及胎儿染色体三体发病率计算,根据其临床预期用于产前筛查的用途,按照发病率计算建议总例数不少于 10000 例。
试验要求能够筛选出一定数量的 T21 阳性、至少 1 例的 T18 阳性和至少 1 例的 T13 阳性。如未筛查出符合要求的阳性病例数量,则应继续增加样本例数进行筛查,所有样本均应可以溯源。
4. 其他要求
4.1 对于临床试验中可能会出现用于核型分析的细胞培养不出导致数据缺失的情况:密切关注该病例并建议孕妇做二次穿刺,最终确定结果可纳入统计分析;
4.2 关于失访率的要求:核型分析属于有创检测,如孕妇拒绝二次穿刺将导致数据失访;出生随访可能有部分数据失访。因此,可接受的失访率应控制在高危孕妇≤2%,低危孕妇≤10%,且失访数据应说明原因。
4.3 临床试验结果的客观内容(包括失访率等)建议在产品说明书中明示。
5. 临床试验方案
5.1 申请人按照上述 1—4 要求并结合体外诊断试剂注册申报相关法规制定临床试验方案。需遵循如下要点:
5.1.1 各临床研究机构的方案应基本一致,且保证在整个临床试验过程中遵循预定的方案实施,不可随意改动。临床试验方案的修改过程和版本要记录在案,且每次改动应记录原因。
5.1.2 整个试验过程应在临床研究机构的实验室内并由本实验室的技术人员操作完成,申报单位的技术人员除进行必要的技术指导外,不得随意干涉实验进程,尤其是数据收集过程。
5.2 临床试验方案还应详细阐述如下内容:
5.2.1 临床研究单位选择、临床主要研究人员简介;对临床试验的整体管理情况、质量控制、试验人员培训、仪器日常维护、仪器校准、质控品运行的规定。
5.2.2 临床背景、病例纳入 / 排除标准、样本的预期选择例数及标准。其中须注意,病例纳入 / 排除标准应严格制定并实施,任何已经入选的病例再被排除出临床研究都应记录在案并明确说明原因。在试验操作过程中和判定试验结果时应采用盲法以保证试验结果的客观性,对于编盲的方式应有详细描述。
5.2.3 如采用出生随访方式,则应对出生随访的依据、项目及判定标准进行详细规定,包括但不限于如下内容:随访操作及记录人员、复核人员、随访方式、随访项目、判定依据、随访时间周期及间隔、随访终点等。
5.2.4 样本类型、样本的收集、处理及保存等。
5.2.5 数据预处理、统计学方法、统计软件、评价统计结果的标准。
6. 临床试验报告
临床实验报告包括各机构的临床试验报告以及临床总结报告。根据《体外诊断试剂临床试验技术指导原则》(国家食品药品监督管理总局通告 2014 年第 16 号)的要求,临床试验报告应该与方案呼应并相一致,对方案执行情况及试验结果进行详述:
6.1 样本例数(总结报告应为各机构的样本例数、阳性检出例数等)、孕妇年龄分布情况、建议以列表方式给出具体例数及百分比。
6.2 对检测精密度、质控品测量值的抽查结果评估。
6.3 具体试验过程及试验过程中需要说明的问题,研究过程中是否涉及对方案的修改。
6.4 申报试剂批号、有效期及所用机型等信息,配合使用的试剂、耗材及仪器的厂商信息、货号及产品医疗器械注册证编号。需要强调的是:临床试验研究应使用与说明书描述一致的配套使用试剂及仪器。
6.5 统计学分析:样本的纳入与排除情况;数据预处理、差异数据的重新检测与否以及最终是否纳入数据统计、对异常值或缺失值的处理。另外考虑到对不同年龄段孕妇样本的阳性检出率可能存在一定差异,故建议对不同年龄段孕妇样本分别进行统计分析。
6.6 讨论和结论:对总体结果进行总结性描述并分析试验结果,对本次临床研究有无特别说明,最后得出临床试验结论。
6.7 病例报告表应包括如下信息:孕妇代码、年龄、金标准分析具体结果、该试剂检测结果。其中金标准分析如为核型分析,应明确具体结果;如为出生随访,则应明确胎儿出生时间、随访时间、随访方式、随访结果。病例报告表的全部数据应可溯源。
7. 上市后需完成的工作
上市后需继续搜集至少 10 家临床机构、总数不少于 10 万例临床使用数据作为临床补充资料在产品下一次延续注册时提交,并使用该试剂检测的全部结果(包括阴性、阳性)与卫生主管部门关于胎儿染色体产前诊断技术标准以羊水穿刺核型分析或出生随访结果作为金标准进行对照。对于出现在灰区(如适用)的样本(Z 值临界值区域)应进行分析总结。该项临床资料应当由出具数据各临床机构主管部门签章。此外,注册人还应总结上市期间假阳性和假阴性的例数并详细分析产生原因。
在延续注册时,注册人应依据上市后的临床使用数据进一步修订说明书临床性能相关内容。
三、名词解释
1. 高危孕妇
本指导原则中是指建议实行产前诊断的人群:35 岁以上的高龄孕妇;产前筛查出来的胎儿染色体异常高风险的孕妇;曾生育过染色体病患儿的孕妇;产前 B 超检查怀疑胎儿可能有染色体异常的孕妇;夫妇一方为染色体异常携带者;医师认为有必要进行产前诊断的其他情形。
2. 低危孕妇
本指导原则中是指除去定义为高危孕妇以外的孕妇人群。
四、参考文献
1.《产前诊断技术管理办法》(中华人民共和国卫生部令第 33 号),2002 年 12 月 13 日。
2.《孕妇外周血胎儿游离 DNA 产前筛查与诊断技术规范》(国卫办妇幼发〔2016〕45 号),2016 年 11 月 9 日。
3. 中华人民共和国卫生行业标准(WS 322.1-2010),胎儿常见染色体异常与开放性神经管缺陷的产前筛查与诊断技术标准第 1 部分:中孕期母血清学产前筛查。
4. 中华人民共和国卫生行业标准(WS 322.2-2010),胎儿常见染色体异常与开放性神经管缺陷的产前筛查与诊断技术标准第 2 部分:胎儿染色体异常的细胞遗传学产前诊断技术标准。
5.Cell-free DNA Screening for Fetal Aneuploidy,ACOG, 2015.
6.Noninvasive prenatal screening for fetal aneuploidy, 2016 update, ACMG, 2016.
7.Position Statement from the Chromosome Abnormality Screening Committee on Behalf of the Board of the international Society for Prenatal Diagnosis, ISPD, 2015.
8.Guidelines for diagnostic next-generation sequencing, guidelines for the evaluation and validation, EuroGentest and the European Society of Human Genetics, 2016.
9.Use of Standards in FDA Regulatory Oversight of Next Generation Sequencing (NGS)-Based In Vitro Diagnostics (IVDs) Used for Diagnosing Germline Diseases, Draft Guidance for Stakeholders and Food and Drug Administration Staff, FDA, 2016.
10.《出生缺陷防治报告》,中华人民共和国卫生部,2012。








