
今日,中枢神经疾病治疗领域传来重磅喜讯。美国FDA宣布,由Newron Pharmaceuticals研发的帕金森病新药Xadago(safinamide)获批上市,作为levodopa/carbidopa治疗外的附加疗法。值得一提的是,这也是美国在十多年来首个获批用于治疗帕金森病的新化学实体(New Chemical Entity)。

帕金森病是全球第二常见的老年慢性渐行神经退行性疾病,仅次于阿兹海默病。据估计,全世界65岁以上的老年人中,约有1-2%的人受此疾病影响。随着全球老龄化的加剧,罹患该疾病的人数还有可能进一步增加。目前,左旋多巴是治疗帕金森病最有效的药物,患者群体中服用该药物的比例高达75%。然而,长期使用这款药物可能会导致严重衰弱的运动能力波动。这种波动分为两种阶段——在“开启”期,患者的运动能力一切正常;而在“关闭”期,患者的运动能力会出现明显下降,甚至连行走都困难。因此,随着疾病的发展,这些患者需要额外的药物来应对和管理由于服用左旋多巴而产生的运动能力波动。
今日获批的safinamide正是一款能应对“关闭”期的药物,能选择性抑制MAO-B。作为一种单胺氧化酶(monoamine oxidase),MAO-B会降解多巴胺,而多巴胺能够在脑区传递信号,对于流畅的自主运动非常重要。因此,safinamide有望能避免多巴胺被MAO-B降解。通过这一作用机制,研究人员希望safinamide能缓解帕金森病患者在“关闭”期的运动能力下降。
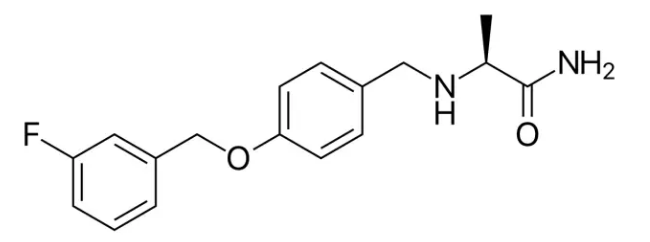
▲Safinamide的分子结构式(图片来源:维基百科)
在两项分别有645名和549名帕金森病患者参与的临床试验中,safinamide的疗效得到了证实。与服用安慰剂的患者相比,那些服用safinamide的患者,“开启”期得到显著延长,“关闭”期则有所缩短。此外,在“开启”期,患者们的运动能力评分也更高,并没有出现不受控制的运动。基于这些数据,FDA在今日批准了这一药物的上市。
“FDA批准Xadago治疗帕金森病患者是一个重要的里程碑,因为它是美国近十多年来获批治疗帕金森病的首个新化学实体,”西奈山医学院的荣誉退休教授Warren Olanow博士说道:“在levodopa/carbidopa的治疗外,Xadago作为一种附加疗法能显著减少‘关闭’期的时间,并显著增加‘开启’期的时间。在‘开启’期,它也不会造成患者的运动障碍。”
“帕金森是一种无情的疾病,没有治愈方法,”FDA药物评估与研究中心神经学产品部副主任Eric Bastings博士说:“我们承诺将把更多帕金森病的疗法带给患者。”
我们祝贺Newron Pharmaceuticals及其合作伙伴取得的成绩,也祝愿更多新药能够上市,治疗罹患中枢神经系统疾病的患者们。
参考资料:
[1] FDA Approves Xadago® (Safinamide) for Parkinson’s Disease (PD) Patients
[2] FDA approves drug to treat Parkinson’s disease
[3] After an odyssey of setbacks, FDA finally green-lights Newron’s Parkinson’s drug Xadago







