
(一)CDER主管Janet Woodcock致辞
这是FDA药品审评与研究中心(CDER)的第6份年度新药审评情况总结。

每一年,药品审评与研究中心(CDER)都审批数以百计的新药,其中绝大部分是由之前已经存在的产品改良而来,例如已获批产品的重要新剂型,或是节省成本的仿制药。这些新产品有助于改善医疗质量,提高药物的可及性,提供更多的消费选择,创造更具竞争力的市场,以强化可支付能力和公众健康。然而,在这些新获批药品中的一小类,我们称之为“新药”(novel drug),指的有助于将临床医疗保健推向另一层次的更具创新的产品。每年岁末,CDER都会对这类产品做一总结。
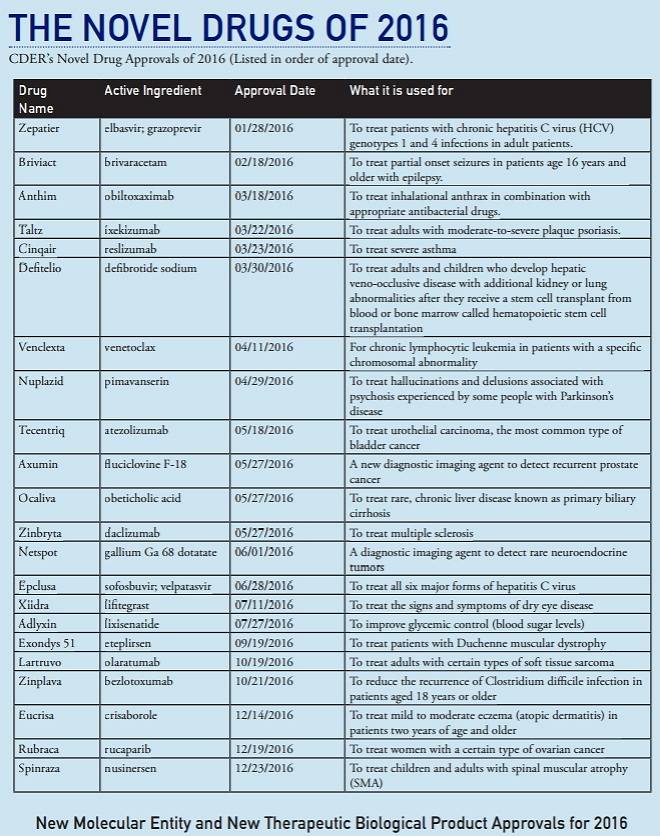
CDER的年度总结(《2016年度新药审批报告》)不仅报告批准的新药数,而且还聚焦于这些新药的医疗价值、对增强患者医疗保健的贡献以及CDER用于帮助确保这些产品安全、有效研发和审批的多种监管工具。2016年获批的新药包括首个用于治疗脊髓性肌萎缩症患者的药物,首个获批治疗杜氏肌营养不良症的药物,一种治疗某些帕金森患者幻觉和妄想的新药,一种治疗原发性胆汁性肝硬化的罕见慢性肝病的新药以及两个治疗丙型肝炎的新药。此外,还包括用于治疗卵巢癌、膀胱癌、软组织肉瘤和慢性淋巴细胞白血病的新抗肿瘤药,以及两种新型诊断试剂,旨在检测癌症的确切类型。
这些新获批的药品均被要求符合FDA严格的上市前安全标准——并成为强有力的上市后监督体系的一部分,以观察这些药品被更广泛的患者群体使用之后效能如何。作为今年新药批准总结的补充,CDER最近的题为《2015-2016 药品安全工作重点》(Drug Safety Priorities 2015-2016)的报告详细介绍了中心的主要安全工作重点,以及CDER和FDA所有药品安全举措的深度和多样性。该报告包括自2015年年初以来实现的更新项目和里程碑项目,描述了FDA在药品安全科学、监测和监管方面的多种最重要的努力。
我们希望这份新药审批总结报告为2016年批准的多种新药在对患者医疗保健方面产生预期影响,以及对CDER在帮助这些药品上市过程中所发挥的重要作用。
Janet Woodcock, M.D. 医师
FDA药品审评与研究中心(CDER) 主任
(二)历史数据比较

1、2016年CDER批准22个新药
2016年,FDA药品审评与研究中心(CDER)批准了22个新药,这些新药是依据新药申请(NDA)作为新分子实体(NME)或依据生物制品许可申请(BLA)作为新的治疗用生物制品获批。
新药(Novel drugs)指的是:一般用于之前未能满足医疗需求或者在其它情况下非常有助于促进患者医疗保健和公众健康的具有创新性的产品。新分子实体具有之前从未获批过的化学结构;但在一些情况下,新分子实体可能具有类似于之前批准的药品功效,不一定比现有治疗药品具有独特的临床优势。这份报告总结了2016年获批的所有新分子实体和新生物制品许可申请批准情况,重点强调了那些满足患者需求的创新型治疗药物。
图1中的纵坐标(vertical bars)是过去十年中,CDER每年批准的新药数。2016年CDER共批准了22个新药,少于过去十年的年均批准数。从2007到2015年,CDER年均批准约30个新药。
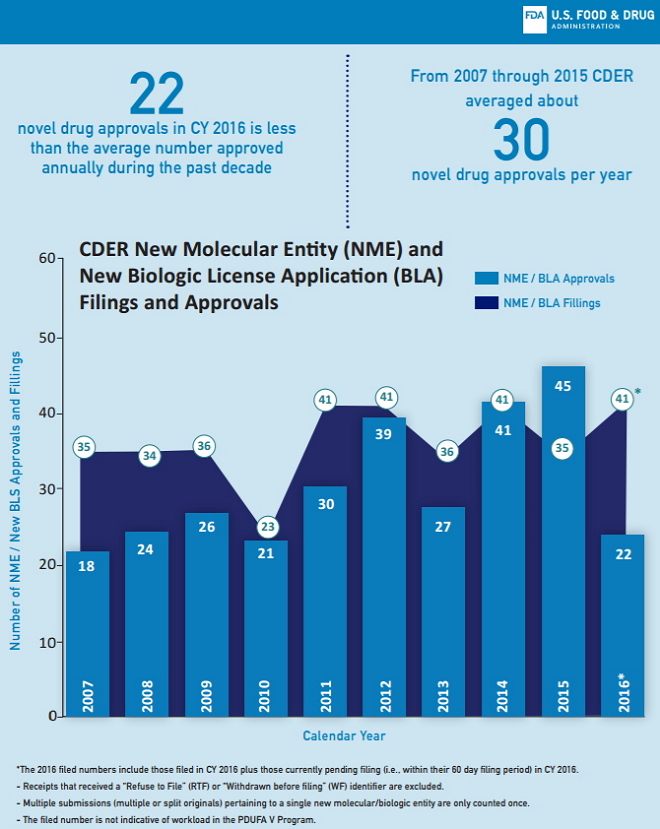
图1:新药审批申请数量和获批数量
备注:* 2016年立卷数包括2016年立卷加上2016年等待立卷(即处于60天的立卷期内)的申请数。
-接到“拒绝受理”(RTF)或是“立卷前撤回”者未包括在内。
-涉及单个新分子/生物制品实体的多次提交(多次或原件分拆提交)只计一次。
-立卷数量并不代表PDUFA V法案所规定的工作量。
2、新药审批申请数保持稳定
2016年CDER批准的新药数低于过去十年的年均批准数,但申请人提交的新药申请数保持相对稳定。
图1中以实线连接的各个点显示过去10年中CDER新受理和立卷审批的作为新分子实体(NMEs)和新的治疗用生物制品(therapeutic biologics)的 NDA和BLA的数量。从2007年到2015年,CDER年均受理约36件新药申请。CDER估计2016年立卷数为41件,与近10年来的数据相持平。

备注:*截止2016年12约31日,这些信息都是准确的。在极少情况下,可能需要FDA变更药品NME认定或作为新BLA的申请状态。例如,在可能有新信息的情况下,可能会重新考虑最初的认定或状态。如果必须变更对药品的认定或是作为新BLA的申请状态,FDA应视情况就任何修订的性质和原因做出主动沟通。
备注:中文翻译参考“最新!FDA在2016年共批准22个原创新药”
(三)对公众健康的影响

在2016年CDER批准的22个新药中,大多数由于对高品质医疗保健和公众健康的潜在积极影响和独特贡献受到极大关注。
1、首创药(First-in-Class)
在2016年CDER批准的22个新药中,CDER认定其中8个(Defitelio、 Exondys 51、Ocaliva、Spinraza、Venclexta、Xiidra、Zinbryta、Zinplava)为首创药,占总批准数量的36%。首创药是衡量药品创新特性的一个指标,这类药品通常具有不同于现有治疗药品的作用机理。
值得关注的首创药包括:
Defitelio:治疗成人和儿童在从血液或骨髓接受干细胞移植(即造血干细胞移植)后发展成的具有肾或肺异常的肝静脉阻塞症;
Zinbryta:治疗多发性硬化。
2、罕见病用药(Drugs for Rare Diseases)
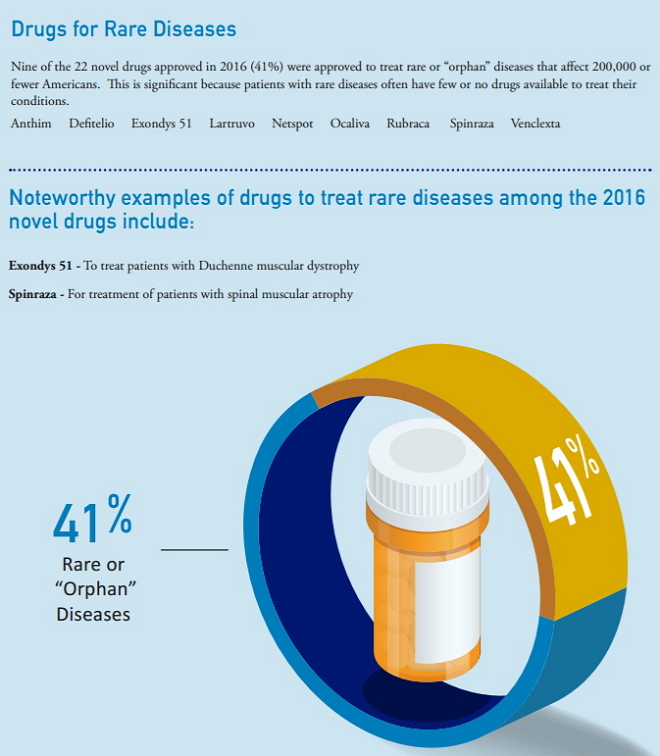
在2016年CDER批准的22个新药中,有9个(Anthim、Defitelio、Exondys 51、Lartruvo、Netspot、Ocaliva、Rubraca、Spinraza、Venclexta)获批用于“罕见病”治疗,约占总批准数量的41%。
这类药物治疗受影响患者数为20万或更少的美国公民,因为他们经常只有很少的药品治疗所患病症甚至是无药可治。
其中值得关注的罕见病用药包括:
Exondys 51:治疗杜氏肌营养不良症患者
Spinraza:治疗脊髓性肌萎缩患者
3、2016年其它值得关注的新药(Other Noteworthy Novel Drugs of 2016)

除了前述具有创新性的首创和用于“罕见病”的新药之外,2016年获批的新药中,还包括其它值得关注的药品。

譬如:包括癌症治疗药,治疗一种称为软组织肉瘤的癌症形式的Lartruvo;用于治疗患有卵巢癌的女性的Rubraca;用于治疗最常见类型的膀胱癌(尿路上皮癌)患者的Tecentriq;以及用于某些慢性淋巴细胞白血病患者的Venclexta。还有两个值得关注的诊断试剂,用于帮助检测前列腺癌的造影剂Axumin,以及用于检测罕见神经内分泌瘤的造影剂Netspot。
这一年的获批药品中还包括2种新的丙肝治疗药品,用于治疗所有6种主要类型的丙型肝炎病毒的Epclusa和用于治疗感染基因型1和4慢性丙型肝炎病毒成年患者的Zepatier。
另外值得关注的获批药品包括治疗与某些患有帕金森病患者经历的精神疾病相关幻觉和妄想的Nuplazid,以及治疗患有被称为原发性胆汁性肝硬化的罕见慢性肝病患者的Ocaliva。
(四)为加快药品上市的创新方法

2016年CDER应用多种监管方法加快新药研发和审批。这些方法包括:快速通道、突破性治疗认定、优先审评和加速批准。
1、快速通道(Fast Track)
快速通道药品有潜力解决未满足的医学需求。2016年获批新药中有8个新药(36%)被CDER认定为快速通道审评。快速通道加快新药研发和审评速度,例如通过增强FDA与药品研发者的沟通水平并使CDER能够在提交完整申请之前审评部分药品申请。
被认定为快速通道的药品有:Anthim、Defitelio、Epclusa、Exondys 51、Lartruvo、Ocaliva、Spinraza、Zinplava。
2、突破性疗法(Breakthrough)
突破性疗法药品是与现有药品相比,具有初步临床证据的药品可能对至少一个具有临床意义的终点(如研究结果)带来实质性改善。2016年获批新药中有7个被CDER认定为突破性疗法药品审评。突破性疗法药品认定通道涵盖快速通道计划的所有特征,以及更为深入细致的具有效率的药品研发计划的FDA指南。突破性疗法认定旨在帮助缩短具有潜力的新治疗药物的研发时间。
被认定为突破性疗法的药物有:Epclusa、Lartruvo、Nuplazid、Rubraca、Tecentriq、Venclexta、Zepatier。
3、优先审评(Priority Review)
如果CDER确定药品能够有潜力对医疗保健做出实质性推动,药品将获得优先审评。药品在6个月内而不是标准的10个月内审评。2016年获批新药中有15个(68%)被认定为优先审评。
被认定为优先审评的药品有:Axumin、Defitelio、Epclusa、Exondys 51、Lartruvo、Netspot、Nuplazid、Ocaliva、Rubraca、Spinraza、Tecentriq、Venclexta、Xiidra、Zepatier、Zinplava。
4、加速批准(Accelerated Approval)
加速批准计划允许提前批准比现有治疗药品有益的用于严重或危及生命疾病的药品。2016年获批新药中有6个(27%)按照加速批准计划获批。审批基于我们认为非常有可能预测药物临床获益的“替代终点”(例如,实验室方法)或其它临床测量。一旦授予加速批准,药品必须经过进一步检验以确认其获益。该通道加速了亟需患者获得药品的可能性。
获得加速批准的药品有:Exondys 51、Lartruvo、Ocaliva、Rubraca、Tecentriq、Venclexta。
5、整体运用多种加速研发和审评方法(Overall use of expedited development and review methods)
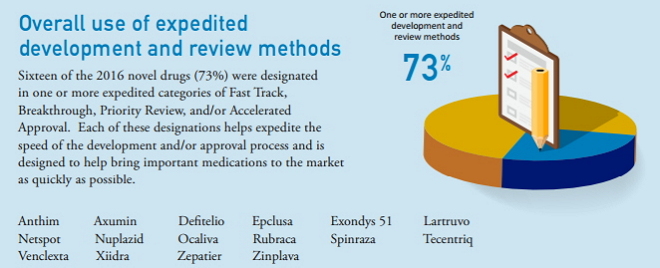
一个或多个加速审评占73%
2016年获批新药中有16个(73%)被认定为快速通道、突破性治疗认定、优先审评和/或加速批准中的一个或多个加速审评类型。这些认定有助于加快研发速度和/或批准流程,旨在帮助尽快将重要的医药产品推向市场。
使用至少一个加速审评计划的药品包括:Anthim、Axumin、Defitelio、Epclusa、Exondys 51、Lartruvo、Netspot、Nuplazid、Ocaliva、Rubraca、Spinraza、Tecentriq、Venclexta,、Xiidra、Zepatier、 Zinplava。

快速通道占36%;突破性疗法占32%;优先审评占68%;加速批准占27%
(五)批准的可预测性和可及性
1、可预见性(Predictability)

实现PDUFA目标时限
根据处方药使用者付费法案(PDUFA),向生产商征收使用者付费,为FDA提供实现绩效标准所需的额外资源。2016年全年,CDER实现或超越了绝大部分PDUFA规定的申请审评目标时限,这些目标时限是与制药产业界协商并经过美国国会批准的。2016年,CDER对于95%的获批新药(22个获批新药中的21个)实现了PDUFA目标时限。
CDER实现PDUFA审评目标的药品包括:Adlyxin、Anthim、Axumin、Briviact、Cinqair、Defitelio、Epclusa、Eucrisa、Lartruvo、Netspot、Nuplazid、Ocaliva、Rubraca、Spinraza、Taltz、Tecentriq、 Venclexta、Xiidra、Zepatier、Zinbryta、Zinplava。
2016年,CDER实现了95%的新药PDUFA目标时限。
2、可及性(Access)
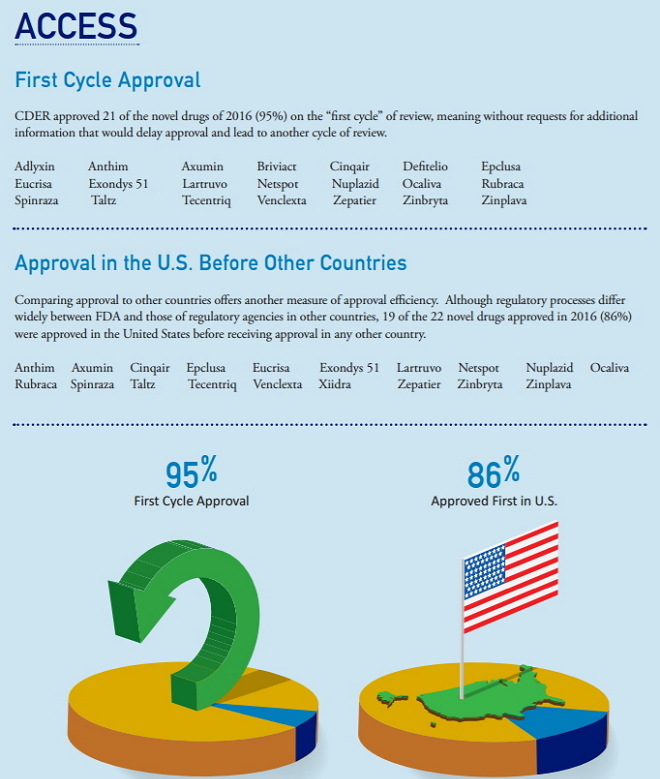
首轮获批(95%)&美国率先批准(86%)
2016年CDER批准的新药中21个(95%)在审评“首轮”获批,这意味着不需要将会延迟审批时间和导致其它轮次审评的额外资料。
首轮获批的药品包括:Adlyxin、Anthim、Axumin、Briviact、Cinqair、Defitelio、Epclusa、Eucrisa、Exondys 51、Lartruvo、Netspot、Nuplazid、Ocaliva、Rubraca、Spinraza、Taltz、Tecentriq、Venclexta、Zepatier、Zinbryta、Zinplava。
将在美国的获批情况与在其它国家的获批情况相比较是作为衡量审批效率的另外一种尺度。尽管FDA与其它国家监管机构的监管流程存在广泛差异,但在2016年获批新药中有19个(86%)在美国获批早于在其它国家获批。
在美国率先获批的药品包括:Anthim、Axumin、Cinqair、Epclusa、Eucrisa、Exondys 51、Lartruvo、Netspot、Nuplazid、Ocaliva、Rubraca、Spinraza、Taltz、Tecentriq、Venclexta、Xiidra、Zepatier、Zinbryta、Zinplava。
(六)结论与总结
1、结论(Conclusion)

本报告为对2016年CDER批准新药的概览。
CDER每年批准新药数量持续上升的趋势必然有赖于提交审批的药品数量相应的增长。在过去十年中,制药与生物技术行业提交的NME和新BLA申请一直保持相对稳定。
比2016年获批新药数更为重要的,是制药产业研发的新药的品质和这些药品对于推进医疗保健事业所发挥的新作用。
引人注目的还有这些新药中绝大部分的审评与批准效率。CDER运用多种加快研发与审评的监管工具,帮助加快这些药品上市。
在所有情况下,在力求新药申请审评与批准效率的同时,CDER在整个流程中保持对有效性和安全性证明的严格标准。
2、药物设计总结(Drug Designation Summary)

3、药物设计综述(Drug Designation Review)

首创药:对治疗条件具有全新及独特机制的药物;
孤儿药:获批治疗罕见病患者的药物;
突破性疗法:具有初步临床证据的药品与现有药品相比,至少有一个临床显著终点超过现有疗法;
快速通道:具有解决未满足的医疗需求的潜力药物;
优先审评:药品能够有潜力对医疗保健做出实质性推动,药品将获得优先审评,CDER旗下的Priority Review Voucher不包括在内;
加速批准:基于早期批准的基础上,发现允许提前批准比现有治疗药品有益的用于严重或危及生命疾病的药品;
PDUFA目标日期:基于处方药使用者付费法案(PDUFA)确定的申请审查目标日期;
首轮获批:未获得额外信息的药品可能会延迟审批时间,导致审查周期的延长;
美国率先批准:在其他国家未批准前率先在美国批准的药品。
参考资料:







