
近日,生物制药公司Stemline Therapeutics宣布,美国FDA已授予其临床新药 SL-401 突破性疗法认定。该新型药物可靶向白介素-3受体(interleukin-3 receptor ,CD123),用于治疗急浆细胞样树突状细胞肿瘤(blastic plasmacytoid dendritic cell neoplasm,BPDCN)。
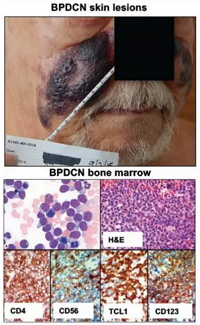
BPDCN的症状(图片来源:Stemline官方网站)
近年来,生物医学研究人员发现了一群叫做癌症干细胞(Cancer Stem Cells)的特殊肿瘤细胞,他们虽然一般只占肿瘤数量的1%到5%,但它们却像“种子”一样具备高度增殖性,能够以此为基础扩散出其他大部分的肿瘤细胞(95%-99%)。
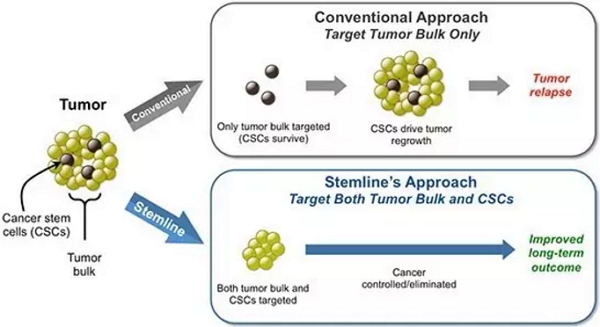
Stemline的治疗理念是靶向癌症干细胞(图片来源:Stemline官方网站)
虽然化疗和放疗等标准治疗方案,最初可能杀伤肿瘤细胞、缩小肿瘤体积,但这些手段未能根除肿瘤干细胞。于是,往往残留的癌症干细胞重新“死灰复燃”,造成肿瘤复发。
Stemline Therapeutics公司是一家临床阶段的生物制药公司,致力于开发新型抗肿瘤药治疗,特别是靶向癌症干细胞。其候选产品 SL-401 就是一种针对存在于癌症干细胞、BPDCN、急性髓性白血病(AML)及其他血液癌症细胞上的白介素-3受体的靶向治疗产品。在这之前,SL-401被美国FDA授予用于治疗 AML 和 BPDCN 的孤儿药资格认定。
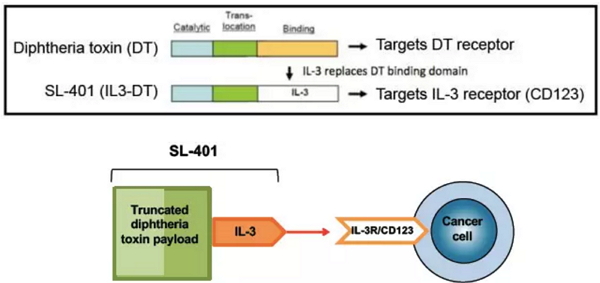
SL-401的构建方法(图片来源:Stemline官方网站)
这一突破性疗法认定是基于使用 SL-401 一线治疗BPDCN患者或治疗复发、难治性患者的2期临床研究,试验结果提供了良好的疗效和安全性数据。Stemline公司正在开展多项癌症临床计划来评估SL-401的疗效。
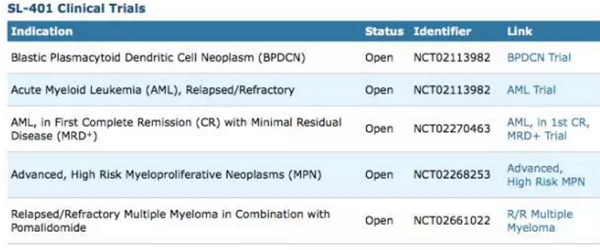
候选产品SL-401正在进行多项临床研究(图片来源:Stemline官方网站)
Stemline的首席执行官Ivan Bergstein博士说道:“我们非常高兴SL-401已被FDA授予了突破性疗法认定治疗BPDCN患者。我们将继续与FDA紧密合作,努力尽快把这个具有前途的治疗方案提供给所有BPDCN患者。鉴于SL-401治疗CD123阳性癌症的有效性,以及其易于管理、与其他抗肿瘤药剂不冲突的安全性特点,我们积极在其他已注册的临床试验中继续开发SL-401作为单一或联合药物,针对这些CD123阳性的癌症适应症。今年晚些时候,我们希望提供多个SL-401临床研究的进一步更新数据。”







