
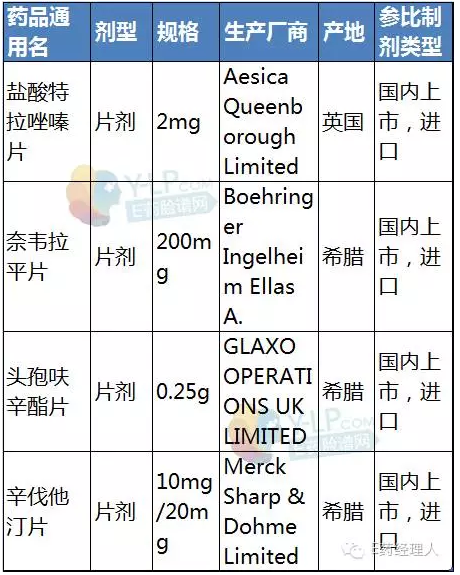
根据中国食品药品检定研究院(下称“中检院”)公布的信息,4个参比制剂分别是盐酸特拉唑嗪片、奈韦拉平片、头孢呋辛酯片和辛伐他汀片。这些品种均为片剂,类型上都是原研药品进口商品。此外,CFDA于7月29日发布了《承担首批仿制药质量和疗效一致性评价品种复核检验机构名单》,并附以289个品种和承担单位的目录,此次的4个品种也均在289个目录内。
E药经理人梳理这四个品种发现:首先,这四个品种均为国内临床应用较为成熟的品种;其次,有相关生产批件的仿制药企数量均在10-20家;其三,这四个品种的参比制剂选择争议性较小;其四,这些品种在市场上有实质销售的仿制药企为数不多。
由此观之,中检院选择公布这四个参比制剂,一方面是为了为正在进行的仿制药一致性评价提供相应的指导意见;另一方面也是选择争议性较小的品种,为新规则的建立进行尝试性的动作。
但是仿制药企们都“被吓了一跳”,原因是自2015年8月国务院发文要求开展仿制药一致性评价工作以来,已经历时近一年,此前对于参比制剂的选择原则是:参比制剂首选国内上市的原研药品;若原研未在国内上市或有证据证明其不符合参比制剂条件,可选用在国内上市国际公认的同种药物;若以上两种均不符合,可选择在欧美日上市并被列为参比制剂的药品。
医药业界对此的理解为参比制剂的选择由企业自主决定并报CFDA备案。但是,现在游戏规则显然正在发生巨大的变化。289个药品的相关仿制药企们现在需要做一个选择:等待官方陆续公布所有需进行一致性评价的仿制药的参比制剂公布之后,再依照细则推进?还是按照自身原来的计划推进一致性评价工作?为此E药经理人记者致电中检院院长李波,但是他并未对此作出直接回应。
正向的解读是:中检院此次公布参比制剂,使得仿制药一致性评价工作向前实质进行了一步,使得相关药企有章可循。
争议的一端是:参比制剂一年时间才公布4个,而要在2018年底完成所有仿制药的一致性评价工作,如何达成,效率堪忧;此外,中检院推荐的参比制剂,是由官方正式认可的金标准?还是仅仅是推荐意义?其三,行业过去一直关心的规格、BE豁免等细节问题仍然存疑。
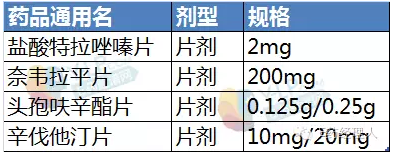
拟评价品种信息
拟定参比制剂信息
1前期投入会打水漂吗?
仿制药一致性评价工作在全国领域正在如火如荼地开展。据最新消息,湖北省的555个需在2018年底前完成评价工作的仿制药批文中,首批62个批文已经进入审评阶段。
尽管CFDA给出了系列的参比制剂的指导原则,但在没有参比制剂目录的情况下,众多药企仍然犹豫难定。此番中检院公布四个参比制剂,所影响的不仅仅是四个品种所涉的药企,也包括其它285个品种所涉的所有仿制药企。他们的疑虑是:如果现在还不确定参比制剂,能否如期完成尚存疑问,如何能保证自身是该品种前三个获得批准?如果其后公布的参比制剂,与现在正在进行一致性评价的参比制剂不同,那么前期所有的投入均有打水漂的危险,尤其是在目前BE试验费用水涨船高的情况下。
某药企总经理告诉E药经理人:“之前CFDA公布了一系列的指导原则,让药企自行选择备案,如今冷不丁推荐4个出来,如果药企选择的和中检院公布的不一样怎么办呢?其他的参比制剂是否会出来?又是按照什么顺序出来,是什么时间出来?作为药企是应该等着金标准的公布?”
2016年5月,CFDA下发关于落实《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》有关事项的公告。其中对参比制剂选择的规定主要是给药企足够的主动权。要求药品生产企业参照《普通口服固体制剂参比制剂选择和确定指导原则》,并按照《仿制药质量和疗效一致性评价参比制剂备案与推荐程序》(《程序》)选择参比制剂后向CFDA备案。
有业内人士猜测,中检院用这么长的时间确定下来的几个参比制剂,原则上应该是经过权衡和验证才定下来的,此次由中检院推荐并公开,如无意外接下来CFDA或许会进行大量的官方公告。
值得注意的是,从公布的4个品种可知,国内有原研制剂上市(进口或本地产)的品种最可能被确定为参比制剂。它们将成为国家开展仿制药质量与疗效一致性评价工作最率先开展的品种,其他暂时难以明确参比制剂的品种可能会暂且后置。
2细节存疑
按照《普通口服固体制剂参比制剂选择和确定指导原则》对仿制药的定义,仿制药是指与被仿制药具有相同的活性成分、剂型、给药途径和治疗作用的药品,参比制剂是指用于仿制药质量一致性评价的对照药品,可为原研药品或国际公认的同种药物。
因此,参比制剂原则上应该是同剂型、同规格间的药品。在此次公布的4个参比制剂中,拟评价品种头孢呋辛酯片的规格有两个,分别是0.125g和0.25g,而推荐的参比制剂的规格只有0.25g。因此,有人提出质疑:头孢呋辛酯片的0.125g如何与0.25g进行对比研究?
根据早前CFDA出台的《人体生物等效性试验豁免指导原则》(BE豁免原则):对于处方相同,活性成分及辅料成相似比例的不同规格同种样品,通常高剂量规格已做过BE试验的,低剂量规格可申请免做BE试验。
这是否意味着头孢呋辛酯片的0.125g规格可以申请BE豁免?专业人士指出,根据早前的BE豁免原则,当口服固体常释制剂在体内的溶出快,且具有很高的溶解度的情况下,对于BCS分类1类和3类的药物,可获生物等效性豁免资格。而头孢呋辛酯在BCS分类系统中属于BCS IV类,即低溶解性、低渗透性,并不在可豁免的范围之内。
3药企生死局开锁
尽管业界尚存疑问,但参比制剂的出炉显然给盐酸特拉唑嗪片、奈韦拉平片、头孢呋辛酯片和辛伐他汀片的仿制药厂家指了一条明路。
据咸达数据统计,国内拥有盐酸特拉唑嗪片批件的企业约20家,主要有赛科药业、海南绿岛以及苏州东瑞等企业。持有奈韦拉平片文号的药企也有10家左右,但产生销售额的药企仅上海迪赛诺生物医药和浙江华海药业,且两家的规则均为200mg。
头孢呋辛酯片在国内约15家药企持有文号,除了原研药厂家GSK,国内仿制药企业有苏州中化药品工业有限公司、深圳制药厂,珠海联邦和深圳致君等。其中,苏州中化有三个文号,分别为0.125g、0.25g和0.5g,销售额也占据优势。
此外,对于市场竞争尤其激烈的辛伐他汀片,国内持有该品种文号的企业众多,据悉,早先SFDA批准盐酸特拉唑嗪片共24个批件,国内企业如浙江京新药业等。
根据早前国家对仿制药一致性评价工作的规定,首家品种完成一致性评价后,其他药品生产的相同品种,原则上应在三年完成一致性评价,同品种药品通过一致性评价生产企业达到3家以上的,在药品政府采购方面不再选用未通过一致性评价的品种。
对于这四个药品的生产厂家来说,参比制剂之门已经被“解锁”,仿制药一致性评价已经真正进入白热化的生死竞赛阶段。
根据CFDA早前的公告,承担以上4个品种的复核检验机构分别是浙江省食品药品检验研究院、安徽省食品药品检验研究院、广东省药品检验所以及四川省食品药品检验检测院。







