目前肿瘤个性化药物研发最热门的领域包括非小细胞肺癌、乳腺癌和白血病等,其原因主要在于基因突变在这些肿瘤中非常常见,且与这些肿瘤相关的生物标记物的研究也较为成熟。本文主要从靶点、适应症以及销售额预测等方面,介绍2015年FDA批准的2个非小细胞肺癌领域的个性化药物——Alecensa (alectinib)和Tagrisso(Osimertinib),这两个药物分别是由罗氏和阿斯利康研发上市的。
Alecensa(alectinib)
公司:罗氏
靶点:间变性淋巴瘤激酶(ALK)
化学结构:

Alecensa(alectinib)是由罗氏及其子公司Chugai制药开发和上市的针对ALK重排的口服肿瘤个性化药物。2014年9月Alecensa在日本上市,用于治疗ALK阳性非小细胞肺癌,随后该药于2016年1月在美国上市,用于治疗ALK阳性且克唑替尼难治的转移性非小细胞肺癌。由于Alecensa对ALK阳性非小细胞肺癌患者治疗效果优异,该药在审批道路上也是一路绿灯。2013年6月,FDA授予Alecensa用于治疗ALK融合基因阳性且在克唑替尼治疗后仍有进展的非小细胞肺癌患者的突破性疗法认定。2015年1月,FDA又授予Alecensa治疗ALK阳性非小细胞肺癌的孤儿药地位。7月,罗氏向美国FDA提交Alecensa用于治疗ALK阳性的局部晚期或者转移性非小细胞肺癌患者的新药上市申请,为那些对克唑替尼治疗不再响应的患者提供一种新的治疗选择。9月FDA优先审评了该药的新药申请,12月Alecensa又被授予了针对上述适应症的加速审批资格,并与次年1月顺利上市。
ALK基因重排大约存在于5%的非小细胞肺癌患者中,这种突变常见于非吸烟的非小细胞肺癌腺癌亚型患者中。医生在使用Alecensa之前应先对患者进行ALK基因检测,从而判断该药是否对患者有益。Alecensa治疗非小细胞肺癌的机制是通过阻断ALK蛋白活性,从而阻止非小细胞肺癌细胞的生长和转移。
在转移性癌症中,癌细胞会转移到身体的各个部位,而对于ALK阳性非小细胞肺癌患者来说,脑部是癌细胞转移最常见位置。Alecensa除了对肺中肿瘤有效以外,对已经转移至脑部的肿瘤也显示了积极的作用。
FDA批准Alecensa主要依据两项临床试验结果,试验针对ALK阳性转移性非小细胞肺癌患者,这些患者的病情不能被克唑替尼有效控制。研究对象每天2次Alecensa给药。在第一项研究中,38%的受试者肺部肿瘤部分缩小,这种效果平均可以持续7.5个月。在第二项研究中,44%的受试者肺部肿瘤部分缩小,这种效果平均可以维持11.2个月。试验也评估了Alecensa对于癌细胞已经转移至脑部的非小细胞肺癌患者的作用,对于脑转移的受试者,61%的患者的脑肿瘤完全或部分缩小,效果平均可持续9.1月。
Alecensa上市之前,AKL阳性非小细胞肺癌市场上的已有的治疗药物是辉瑞公司的克唑替尼(2011年获FDA批准)与诺华公司的色瑞替尼(2014年获FDA批准)。由于AKL重排的患者在非小细胞肺癌病人中所占比例不高,据Thomson Reuters数据统计,2015年克唑替尼的销售额为4.88亿美元,预测到2020年其销售额有望达到7.43亿美元。而色瑞替尼目前仅仅批准用于克唑替尼无效或耐药的患者,其上市首年销售额仅为3100万美元,预计之后几年销售额会有所上涨,到2021年可达到5.06亿美元。2014年Alecensa首次在日本上市,销售额为1330万美元,随着Alecensa在美国上市,其销售额也会大幅增长,预测到2021年,销售额将达到6.21亿美元(图1)。
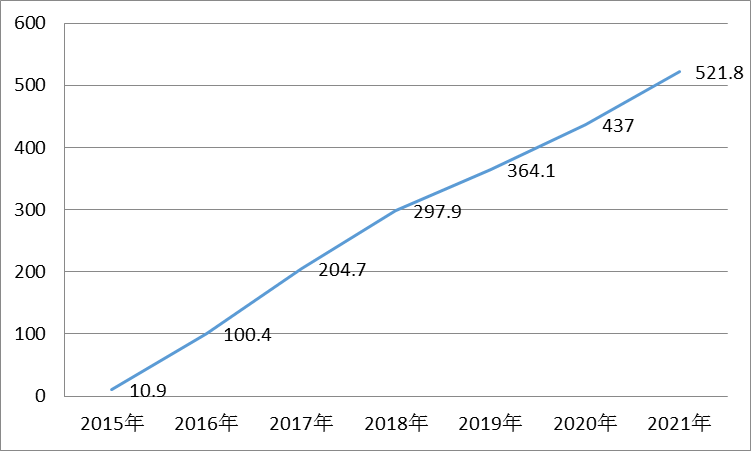
图1 Alectinib全球销售额预测(百万美元)
Tagrisso(Osimertinib)
公司:阿斯利康
靶点:表皮生长因子受体(EGFR)
化学结构:
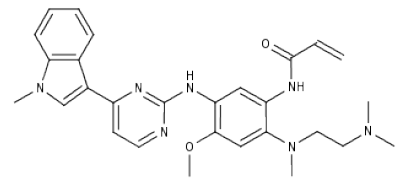
Tagrisso(osimertinib, AZD-9291)是由阿斯利康开发上市的EGFR抑制剂,2015年11月,该药被美国FDA批准上市,用于治疗EGFRT790M突变的晚期非小细胞肺癌患者的二线治疗。在一线治疗方面,2015年4月,阿斯利康向FDA提交一线治疗EGFR突变非小细胞肺癌申请,并期望在2017年获批,2015年11月,FDA授予其优先审评资格。在二线治疗方面,2014年4月,该药被FDA授予突破性疗法资格,针对接受过FDA批准的EGFR靶向抑制剂治疗后仍有进展的EGFRT790M突变阳性的非小细胞肺癌患者。2015年6月,阿斯利康向FDA提交Tagrisso作为EGFRT790M突变阳性的非小细胞肺癌患者二线治疗的申请,11月进入快速审评通道,并且在当月就获得上市批准。从临床实验到获得批准仅仅用时两年半,这大概是美国临床开发最快的纪录,也是阿斯利康史上最快的研发项目之一,这主要归因于FDA授予的“突破性药物”、“罕见病药物”认定、“优先评审”等奖励资格。Tagrisso是目前唯一批准用于EGFRT790M突变转移性非小细胞肺癌的药物,也是针对EGFR靶向治疗药物产生耐药性问题药物研发史上的里程碑事件。
通常肺癌细胞中EGFR蛋白会过度表达,从而使肿瘤生长更快。EGFR抑制剂主要通过阻断EGFR蛋白信号通路来发挥抗肿瘤的作用,但是EGFR抑制剂在一段时间治疗之后几乎都会产生耐药问题,主要由于EGFR会产生新的突变,T790M突变就是其中之一。Tagrisso是新一代EGFR抑制剂,主要针对EGFR T790M突变的非小细胞肺癌。FDA在批准Tagrisso的同时,也批准了其检测试剂盒伴侣,用于T790M突变的检测。在2个单组、多中心、共有411名受试者参与的Ⅱ期临床试验中,这些受试者是经其他EGFR抑制剂药物治疗后病情恶化的EGFRT790M突变阳性的晚期非小细胞肺癌患者,两个试验中Tagrisso的客观应答率(ORR)分别为57%和61%,在一项中期实验中,Tagrisso展现出的中位无进展生存期为8.6个月。据Thomson Reuters预测,2016年Tagrisso销售额可达到2.96亿美元,随后将逐年上升,到2021年有望达到15.43亿美元(图2)。

图2 Tagrisso全球销售额预测(百万美元)







