谈起药品审批,无论是大型药企,还是小药企,大家都有话说,“审批速度太慢。”
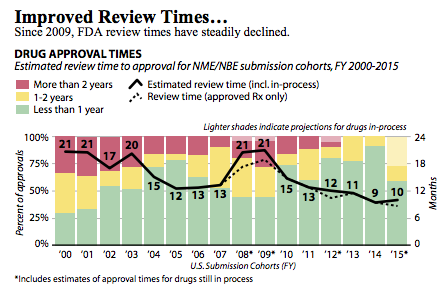
图1:2000-2015年FDA药品审评速度
近日,国际知名的医药健康媒体MedCity的记者Meghana Keshavan发表了一篇图表文章,文章引述了来自加州生命科学协会和波士顿咨询(BCC)的数据:记载了美国食品药品监督管理局(FDA)从2009年到2015年,FDA在新药批准上的时间变化。2009年,只有不到3成的药物在1年内被FDA批准;超过1/4的药物从申报到被批准的时间超过2年,一般药物平均需要21个月被批准;2015年,药物平均只需要10个月被FDA批准(见图1)。
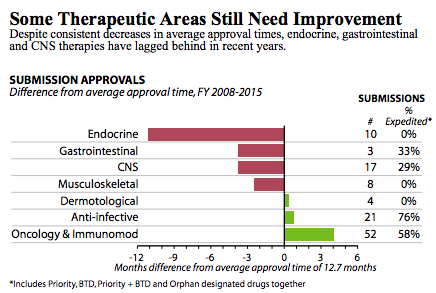
FDA对肿瘤、传染病和罕见病药物的批准速度显著提高;而内分泌、胃肠道和中枢神经系统的药物审批速度仍需加速(见图2)。
是什么原因使得FDA对新药审评的速度越来越快呢?这主要得益于2012年涉及处方药、医疗器械、仿制药、生物仿制药生产企业的FDA安全与创新法案(FDASIA)的正式生效,FDA可以向企业收取用户费用以支持创新型新药、医疗器械仿制药和相似生物制品(生物仿制药)的评审;尤其是“突破性疗法”(“Breakthrough Therapy Designation” )的认证,允许允许审查时间缩短至60天。
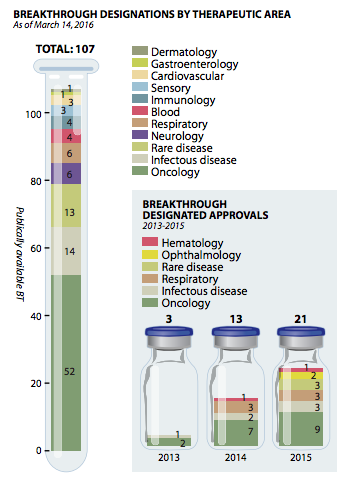
据统计,大多数是“突破性疗法”被授予在突破治疗肿瘤学、传染病和罕见疾病领域(见图3):其中在2015年FDA授予的21个“突破性疗法”认定中,有9个是肿瘤药;传染病、呼吸道和罕见病领域各3个;眼科领域2个;1个为血液病领域。
报告指出:一般抗肿瘤类药物提交给FDA后,较容易通过加速审评;奇怪的是,心血管药物加速审评的比例并不是很高,具体见图4。

图4:2000-2015年加速审评与常规审批对比
推荐阅读:
Infographic: FDA has drastically cut down drug approval times







