一、基因检测公司梳理
目前全国涉及基因检测概念的公司有200余家,按照业务范围划分,这些公司可以分为:①最上游的基因检测仪器开发企业(测序仪、芯片扫描仪、PCR设备),②提供样本处理试剂和耗材的中上游企业(建库试剂盒、检测试剂盒、工具酶、基因芯片),③提供第三方基因检测服务的中游企业,④提供测序数据存储、分析和出具报告的下游企业,⑤还有将这三部分整合起来提供CRO服务的商业公司,当然如果公司研发实力和经济实力允许,大部分公司会选择向上下游产业链延伸,进一步提升自己的盈利能力。
按照基因检测公司的服务内容,主要可以分为四类:科研服务、第三方临床基因检测服务、直接面向个人的检测服务、非医疗基因检测服务(例如食品、环境、刑侦等方面的应用)。
科研中的基因检测服务又分为两种情况,第一种是纯科研服务,检测目的纯粹是满足科研需要,不作为医学诊断的依据;第二种是以科研的名义为患者提供医学诊断服务,医生在其中起主导作用,推荐有需要的患者去做基因检测,医生在其中所获得的好处是得到用药指导依据、科研数据、获得销售提成,这是当前肿瘤基因测序普遍采用的手段,因为目前国内还没有一种获批临床的肿瘤高通量检测试剂盒,只能以科研的形式变相的进行医学诊断从而获取收益。纯科研基因检测市场在百亿级别。
第三方临床检测机构是指批准为医院提供检测外包服务的独立医学检验实验室,大部分第三方临检机构都能开展分子诊断服务(需通过临检中心的PCR实验室认证),例如QPCR、ddPCR、基因芯片等,但是高通量测序在临床检测上的应用当前受到限制,只有在试点名单上的机构才能出具正式的临检报告,目前出台了第一批四个领域的试点名单,分别是遗传病诊断、产前筛查与诊断、植入前胚胎遗传学诊断、肿瘤基因测序,试点单位名单由卫计委医政医管局和妇幼司共同制定。临床基因检测的市场空间在千亿级别。
提供面向个人基因检测服务的商业公司,提供的是非诊断性基因检测,例如23andMe是美国本地唯一一家被FDA批准的能够直接向个人提供基于基因检测分析服务公司,业务范围也仅仅提供祖源分析、遗传病筛查、酒精耐受、基因寻亲这四类遗传分析服务,23andMe此前的疾病风险筛查和药物过敏分析被禁止,而我国有许多直接面向个人的基因检测商业机构,业务范围甚至包括疾病风险、天赋基因、个性特征分析等一系列基因分析服务,未来有加强监管和整合的压力。商业化B2C基因检测的市场空间在十亿级别。
非医疗基因检测服务的应用包括食品、环境微生物、刑侦检测、检验检疫等方面,主要由非医学的商业检测中心来开展,主要采用的技术是荧光定量PCR、基因芯片,测序技术用得较少。例如中德美联是法医DNA检测领域的龙头,主要采用荧光PCR技术,法医DNA检测的市场空间在20亿左右,但是全国共有700多个司法检测实验室,有一定的整合难度。整体来看非医疗基因检测服务是碎片化市场,涉及领域多,空间在百亿级别。
当然我们重点关注的还是基因检测在医学诊断上的运用,这个领域受众广,附加值高,市场空间大。
二、基因检测行业到底如何监管?
我国基因产业处在市场兴起的初期阶段,监管制度还十分不完善,给人的感觉十分混乱。2014年以前,我国基因测序行业处于无监管状态;2014年2月,CFDA和卫计委叫停所有基因测序业务,对行业进行集中整顿;2014年3月,卫计委发布《关于开展高通量基因检测技术临床应用试点单位申报工作的通知》,通知要求已经开展高通量基因测序技术,且符合申报规定条件的医疗机构可以申请试点,同时明确申请试点的基因测序项目。2014年12月,卫计委医政医管局发布遗传病诊断、产前筛查与诊断、植入前胚胎遗传学诊断这三个专业的第一批基因测序临床试点名单;随后2015年1月,卫计委妇幼司正式批准108家医疗服务机构开展NIPT高通量测序技术临床试点,并审核通过13家机构开展植入前胚胎遗传学诊断临床试点;2015年3月,医政医管局发布了第一批肿瘤诊断与治疗项目高通量测序临床试点名单。此后CFDA批准了几款用于高通量测序的仪器、检测试剂等。那么基因检测产业到底由谁监管,怎么监管,监管的范围是什么?我们做了以下梳理。
监管部门:整个基因检测行业涉及细分产业众多,包括医院、临检中心、仪器试剂、商业公司、不同的技术平台等,所以涉及的监管部门也较多。①发改委,从宏观上制定基因检测产业的发展规划:2015年6月,发改委发布《国家发展改革委关于实施新兴产业重大工程包的通知》,其中提到要重点发展基因检测等新型医疗技术,并将在3年时间内建设30个基因检测技术应用示范中心,快速推进基因检测临床应用以及基因检测仪器试剂的国产化;此外地方发改委还参与基因检测项目的定价,例如四川发改委定价无创产前2400元/次。②卫计委主要是对开展基因检测机构的资质进行审查和规范,具体由三个部分监管,分别是医政医改局、妇幼司、临检中心:医政医改局先后发布遗传病诊断、产前筛查与诊断、植入前胚胎遗传学诊断、肿瘤诊断与治疗这四个专业的第一批基因测序临床试点名单,《药物代谢酶和药物作用靶点基因检测技术指南(试行)》,《肿瘤个体化治疗检测技术指南(试行)》等规范;妇幼司则针对产前检测在医政医改局试点名单的基础上增加了108家医疗服务机构开展NIPT高通量测序技术临床试点,并审核通过13家机构开展植入前胚胎遗传学诊断临床试点;临检中心的职责是承担临床检验质量管理与控制工作,运行全国临床检验室间质量评价计划,建立、应用临床检验参考系统,对开展基因检测服务的医学实验室进行评估和验收,例如。③CFDA,对基因检测链上的仪器、试剂、分析软件进行监管,例如EGFR、KRAS、BRAF、C-KIT、CYP2C9、CYP2C19等基因的检测试剂盒、基因芯片等;在高通量测序方面,CFDA先后批准了几款应用于NIPT的测序仪和检测试剂,但是在肿瘤的诊断方面,目前还没有高通量测序仪和高通量检测试剂盒获批,试点单位只能以自制试剂(LDTs)的形式开展检测。
技术的监管:基因检测中的技术平台主要有PCR(qPCR、ddPCR)、FISH(荧光原位杂交技术)、基因芯片、测序(一代测序、高通量测序),目前除高通量测序临床服务制订了限制政策,只有试点单位才能出具临检报告,其他基因检测技术,如PCR、FISH、一代测序等的使用没有限制,临检单位只要通过了PCR实验室、病理学实验室认证就可以应用这些技术。
机构的监管:什么样的机构能够开展高通量测序临床服务?除了医政医改局和妇幼司发布的试点高通量基因测序技术临床试点单位名单外,还有卫计委批准的“个体化医学检测试点单位“(业内常简称为LDT试点),首批试点单位包括中南大学湘雅医学检验所、北京博奥医学检验所和中国医科大学第一附属医院这3家机构,个体化医学检测试点的广度和范畴,要高于高通量基因测序试点;此外还有一些地方卫生部门所批准成立的检验所,例如“南京高新精准医学检验所”。但是即使没有这些资质,测序服务机构也能以科研报告的形式提供检测服务(规避医学检验的限制),或者与试点医院成立联合实验室,享受利润分成。这些都折射出当前我国基因行业监管的不成熟,美国临检机构采取的是CLIA/CAP认证的形式,很大可能我国未来也会采取类似的认证资质。
应用领域的监管:目前高通量测序临床上的应用还只能试点应用于遗传病诊断、产前筛查与诊断、植入前胚胎遗传学诊断和肿瘤诊断与治疗四个专业方向。但是在心血管领域、感染性疾病、肠道微生物宏基因组学等领域,二代测序都有良好的应用前景,当前的临床高通量测序试点只是LDT试点在某个专业方向的具体应用,未来应用领域会越来越广。
仪器试剂的监管:由CFDA进行审批,高通量测序中需要申报的有测序仪(绑定上机试剂)、建库试剂盒、检测试剂盒、分析软件等。NIPT方面,CFDA先后批准了华大基因(BGISEQ-100基于life的Ion Torrent技术、BGISEQ-1000基于华大基因之前收购的Complete Genomics的测序技术)、达安基因(DA Proton基于life的Ion Torrent技术)、博奥生物(BioelectronSeq 4000基于life的Ion Torrent技术)、贝瑞和康(与Illumina合作的NextSeq CN500)的NIPT二代基因测序仪和配套试剂(13、18、21号染色体三体检测试剂盒、上机测序试剂);在肿瘤方面,目前目前还没有高通量测序仪和高通量检测试剂盒获批,试点单位只能以自制试剂(LDTs)的形式开展检测服务。从长远来看,多目标基因panel(几十上百个基因或靶点)高通量检测试剂盒基本没有获批的可能,因为位点突变率很低,很难找到足够的病人开展临床试验,并且检测结果也无法去验证,所以这类试剂盒只能以LTDs的形式在临检实验室使用,无法外售;而少量目标基因(数个基因,少量突变位点)的检测试剂盒可能会被CFDA审批,但是从检测成本来说,少量目标基因的检测成本不会比多目标基因检测低,所以终端价格相差不大,当与多目标基因panel一起进行市场推广的时候,并不具有优势。
总结:当前国内高通量测序在临床上的应用监管还很不成熟,试点名单是名义上具有出具临床检验报告资质的机构,并不是其他机构开展测序服务的限制条件(能以科研的形式开展服务),仪器、试剂的审批也不具备限制性,市场处于洗牌阶段,基因检测公司需要积极进行两手准备,一方面筹备临检资质的申报,积极布局医院终端,一方面着手仪器、试剂的审批。我国未来可能采取和美国类似的CLIA/CAP审批,优先布局医院渠道的有望受益。
案例(美国CLIA认证):在美国,只要通过了CLIA(Clinical Laboratory Improvement Amendments,临床实验室改进法案)认证,第三方实验室就可以根据市场需求,开发出各种新的诊断试剂或服务,即自建项目或者自制试剂(LDTs)。这种检测只能在该实验室内使用,不能外传或者出售给其他任何实验室或者医疗保健机构,从而将风险控制在有限的范围,因而不需要FDA的批准。同时,由于CLIA认证的是实验室,所以并不需要对每个新服务或产品作出审批申请。医院或者病人可以根据自己的需要,选择相应的诊断项目。这个政策给了第三方实验室极大的自由空间,也带来了美国独立实验室的繁荣发展。CLIA 认证最独特的地方在于,实验室自建项目即使在没有FDA批准的情况下,也完全可以在其实验室范围内提供分子检测业务来指导临床。只要是有CLIA执照的实验室,他们自己研发的制剂、技术等也可以合法地进入临床,合理收费。这样做的好处就是:在巨大的医疗需求、和日新月异的新技术面前,所有的CLIA实验室可以跟据市场需求,快速地开发出各种新的诊断应用。同时,美国政府不必对应接不暇的每个新应用做出回应。而病人可以根据自己的需要,即时得到新的诊断服务。同时FDA可以选择FDA认为真正好的诊断方法做进一步认证,并以FDA的名义发布认证,以加速FDA认为好的诊断方法在市场上的应用。申报企业只要通过了CLIA认证,并能保证产品的质量,那么就可以直接应用于临床上。
三、基因测序重在服务
基因测序重在服务,很难单独依靠商品(检测试剂盒、芯片)来建立优势,这与免疫诊断、化学发光有所不同,因为基因检测归根结底都是DNA一级序列的检测,与二级、三级结构无关,检测原理相对简单,都是通过DNA引物靶定待测序列,然后通过引物延伸来实现序列的测定;相反,样品DNA的提取、建库和捕获的操作倒是比较繁琐,需要专业的技术人员去操作。上游仪器已然被少数几个公司所垄断,中上游的试剂盒产品并不具有很高的技术壁垒(当然如果能在建库环节和捕获环节形成明显技术优势,或者是开发出效率更高的工具酶,也是很有发展前景的),而且高通量基因检测试剂盒的审批存在较大的不确定性(未来可能参照美国CLIA认证的方式,具有资质的检测机构以LTDs自制试剂的形式使用,但是不通过药监局的审批就无法对外销售),医院样本量有限,先进入的肯定会占据诸多优势,NIPT市场已经接近饱和,肿瘤医院的争夺也日趋白热化,所以率先通过服务来抢占市场,这或许是较为稳妥的选择。
医院是否会自行购置测序仪开展高通量测序?如果医院自己测序,那么临检测序机构势必难以竞争,所以思考这个因素是有必要的。这个问题要分开来看,一方面考虑用户的数量和需求,一方面考虑测序成本。以当前高通量测序用的最广泛的是NIPT和肿瘤诊治为例进行分析:
在无创产前诊断领域,我国每年的新生儿在1500万人左右,潜在客户基数大,NIPT能够给出明确的诊断结果和对应的防治措施,而且结果关系到下一代的健康,检测价格在2400元左右,受众广泛;此外,NIPT对测序的精度要求不是特别高(目前主要是针对13、18、21号染色体的三体检查),检测是一个定量的过程,通常采用life ion torrent平台(目前获批的5款仪器里面3家申报的是ion torrent,而且美国已经有机构采用基因芯片来做NIPT),很多大型医院能够自行开展NIPT服务,第三方测序机构的目标市场应该在中小型医院。
但是高通量测序在肿瘤领域的应用就不太一样,我国每年新增肿瘤患者在450万人左右,肿瘤panel测序的价格在8千到2万之间,而且现在做肿瘤panel测序的患者主要目的是获得靶向药物用药指导,靶向药物价格比较昂贵(每个月的用药开销在5万左右),所以目标人群就更加狭窄了;此外,肿瘤检测对测序精度要求比较高,主要针对点突变或者微缺失微重复,对技术平台的要求高,通常采用Illumina Hiseq/next Seq测序仪,仪器设备昂贵,并且开机试剂耗材的花费高(一次开机在15万左右),如果没有足够的样本量,基本上每次开机都是亏损;并且肿瘤数据的分析比较复杂,需要专门的生物信息学人才和数据库,所以在肿瘤领域(在其他病患更少的领域更是如此),我们认为高通量测序还是以第三方临检机构为主,目标市场在大型医院。
四、液态活检技术(ctDNA、CTC、外泌体)
要弄清楚液态活检(Liquid Biopsy)是什么,可以先了解一下什么是活检。“活检”即活体组织检查,是指从患者体内切取、钳取或穿刺等取出病变组织,进行病理学检查的技术。这是诊断病理学中最重要的部分,对绝大多数送检病例都能做出明确的组织病理学诊断,被作为临床的最后诊断。普通的活检通常要经过手术或者穿刺来获得组织样本,而且有时候需要反复多次的进行取样,不仅繁琐,给患者增加痛苦,而且有时候取样不准确,例如穿刺有时取到正常组织。而液态活检是对患者血液中的游离的标志物进行检查,不仅取样更加方便,而且能够在疾病的更早期获得检测结果。
液体活检对于我们来说其实并不陌生,例如目前已经较为成熟的NIPT就是液体活检技术,以前要对胎儿进行检测要进行“羊水穿刺”,这会造成一定的流产风险,而NIPT就是对母体外周血中游离的胎儿DNA进行检测,从而实现了无创检测。液态活检的另外一大应用是癌症领域,常规组织活检在癌症诊治中有一定的局限性:第一,癌症有异质性,对于已经发生转移的癌症患者而言,仅仅取某个部位的癌组织,并不能反映患者整体的情况,但是,对所有的癌组织都取样又不好操作;第二,有些患者自身的情况决定了他不适合组织活检;第三,有些肿瘤在受到手术的扰动之后,有加速转移的风险;第四,即使所有的条件都适宜,组织活检的滞后性对患者的治疗也是不利的。
癌症液态活检的标志物主要有三种:ctDNA、CTC、外泌体。
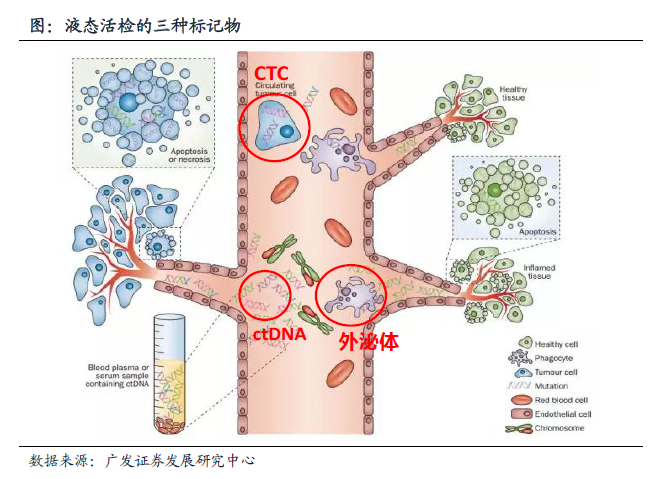
4.1 看好ctDNA检测
ctDNA(circulating tumor DNA)即循环肿瘤DNA,是人体血浆中游离的DNA (cell-free DNA,cfDNA)的一种,ctDNA是癌细胞死亡时产生的DNA碎片,携带了大量癌细胞的信息,因此通过分析血液ctDNA,可以了解患者癌细胞的突变情况。这些突变的信息能够反映患者体内癌症的进展情况,以及为患者选择合适的治疗药物。
ctDNA检测的技术平台:目前在ctDNA检测领域潜力最大的技术平台是第二代测序(NGS)和数字PCR(ddPCR),这两个技术灵敏度较高,保证了检出下限,ctDNA含量很低,大多低于cfDNA总量的1%,其他技术很难从正常组织DNA中检测出异常的ctDNA。虽然目前也有研究用qPCR和基因芯片(产前检测)检测ctDNA的,但是灵敏度肯定还是大大低于NGS和ddPCR,而且随着未来靶向药物数量的增加,对检测通量会有更高的要求,这或许会限制低通量检测技术的应用。需要注意的是ddPCR、qPCR、基因芯片都只能检测已知突变位点。
ctDNA高通量测序中的主要技术:
cfDNA的提取,有虑柱法(以Qiagen为主)和磁珠法两种,如果是ctDNA检测那么一般采用Qiagen的虑柱法,因为提取效率高,而且ctDNA测序所需的外周血量大,一般为5mL;磁珠法可以用于NIPT的检测,因为母体中胎儿游离的DNA量比较丰富,可以达到母体外周血中cfDNA总量的10%,磁珠法的优势是简单快速,所需的外周血低至0.1mL。
在cfDNA中筛选ctDNA,有两种方法:第一种是多重扩增子技术,即针对要检测的癌症相关基因涉及相应的引物,通过引物扩增来获得目标序列,这种方法的好处是能够通过扩增提高检出下限,但是多重扩增涉及到反应均一性的问题,所以一般用于几十个目标基因的检测;第二种方法是捕获技术,设计探针直接从提取的cfDNA中找到ctDNA,然后通过载体将探针与ctDNA复合物拉下来,再进行分离,当前的捕获效率一般在70%左右;捕获技术的优点是可以设计大量的探针,目标基因可以达到上千个。
当前测序公司ctDNA的测序深度在2000x到20000x左右,所采用的技术平台主要是Illumina的Hiseq/NextSeq以及life的ion Proton,据调研反馈,Illumina技术平台的稳定性比Life的要好一些,有公司正在筹备拿Illumina的NextSeq和life的ion Proton向CFDA申请肿瘤测序审批。
ctDNA在肿瘤诊治中的广阔前景:
肿瘤实时监测,ctDNA的含量与肿瘤负荷及疾病进展相关, 通过NGS对ctDNA进行定量分析,可以评估肿瘤大小变化,实现疾病实时监测。
检测肿瘤进化(耐药),通过高测序可以检测肿瘤的主要突变位点变化,而定点检测手段(如ddPCR、qPCR),在评估和监测肿瘤克隆演化方面具有较大的局限性。
应用于肿瘤早期筛查方面,多项研究证明ctDNA在肿瘤早期已经存在于外周血中,若与高灵敏度检测技术结合,将有非常好的肿瘤早期筛查和残留微病灶(MRD)检测潜力。
检测肿瘤基因分型,有研究表明ctDNA与组织样本中得到的检测结果总体吻合率在80%左右,可以根据ctDNA的测序结果制定用药策略,比如欧盟于2014年批准了阿斯利康易瑞沙(Iressa)血液ctDNA伴随诊断,用于筛查受益人群。
国内在ctDNA测序领域比较靠前的是:思路迪、世和基因、燃石生物、华大基因、贝瑞和康等。随着二代测序技术的快速发展,技术灵敏度和特异性不断提高,最有希望在临床得到广泛应用的也许会是ctDNA。
4.2 CTC检测
CTC即循环肿瘤细胞(Circulating tumor cell,CTC)是指从实体瘤中脱离出来并进入外周血液循环的肿瘤细胞。CTC在患者的血液中的含量实际上是极低的,大约每100万个血细胞(约1mL血液)中才混杂着1个肿瘤细胞,因此从血液中捕获CTC技术难度较高。主要的分离方法和免疫治疗原理十分类似,依靠具有癌细胞特异性的抗体识别癌细胞表面的抗原,从而达到捕获癌细胞的目的。另外,CTC要比血细胞大,还可以根据体积大小用“虑筛”的方法分离。
CTC的几种分离方法:
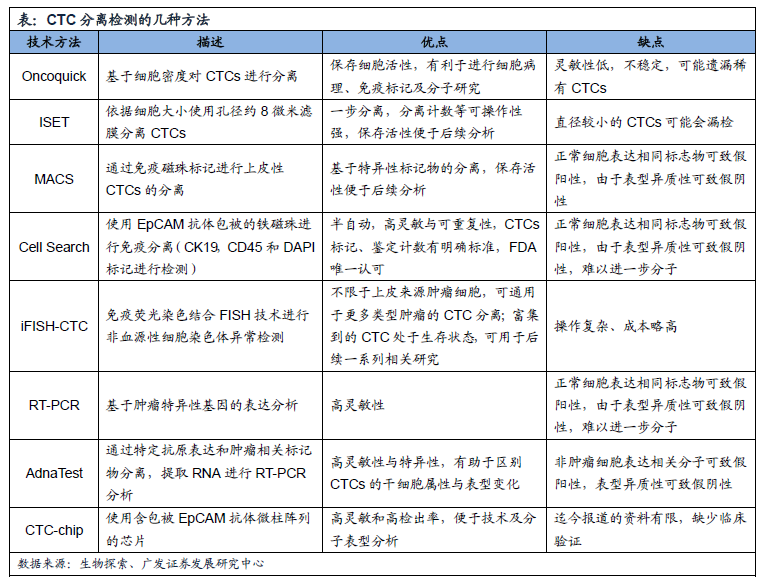
CTC的应用:已经完成及正在进行的大量研究显示,CTC在临床上具有较大的应用价值。目前,CTC在临床上的应用主要包括以下几个方面:
早期筛查:研究发现,在早期肿瘤患者中,利用影像学还未发现病灶时已经可以在外周血中检测到CTC,因此CTC可以用于肿瘤的早期诊断,2007年ASCO就将CTC纳入了肿瘤标志物。在临床上,也遇到过非常典型的案例,一受检者利用CTC做肿瘤早期筛查,在外周血中检出1个CTC,后又通过数字PCR技术对ctDNA进行了定量分析,结果提示该患者肿瘤与结直肠相关性较大。在随后进行的肠镜检查中,在受检者结直肠部位发现一个低分化腺瘤。
快速疗效评估——作为肿瘤生物动力学标志物:通过CTC在不同治疗阶段的数目变化,可辅助快速评估手术、放化疗及其他治疗手段的疗效。
辅助肿瘤患者分期分级:通过检测CTC数目,辅助评估肿瘤患者的分期及分级。血液系统是肿瘤转移的重要途径,是否发生远处转移是判断临床分期的标准之一。近年来,CTC检测在临床上的应用使之成为了TNM传统分期系统的有效补充,从而指导下一步的治疗。
判断患者是否需要辅助化疗:术后CTC数目大于阈值,建议强化术后辅助化疗;CTC数目小于阈值,建议采用标准辅助化疗。
监测癌症转移复发风险:CTC数目上升,提示肿瘤进展,转移复发风险增大;CTC数目下降,提示肿瘤缓解,转移复发风险降低。
提供预后相关的分子生物学特征:目前研究已经证实血液中检测到的CTC可以作为乳腺癌、前列腺癌和结肠癌等肿瘤的独立预后因素。CTC监测数目越高,提示患者预后较差。在转移性乳腺癌患者接受系统治疗之前,每7.5 ml血液中CTC计数超过5 个, 提示更短的无进展生存时间和总生存时间。在转移性结肠癌患者中,每7.5ml血液中CTC计数超过3个,患者中位总存活期和无进展存活期都明显缩短。
监测耐药情况——基于获得连续样本的便利性:通过检测CTC数目变化,实时监测肿瘤药物耐药性的发生。
CTC液态活检应用总结:当前CTC的检测还面临一些挑战,主要体现在:提高CTC的检出率(不依赖抗体的CTC分离策略,CellCullector策略);准确地判断具有生物学活性/功能的CTC(EPISPOT,CAM等策略);CTC细胞分离,单细胞核酸WGA操作等样品制备的SOP和QC方案;CTC本身的异质性等。目前CTC的检测还主要围绕数量指标,CTC的简单计数并不能反应肿瘤细胞内在的生物学特性,而正是这种特性是决定了不同的肿瘤细胞对治疗具有不同的反应。因此,对CTC细胞的分子特性(例如单细胞测序,药物靶向基因的表达,药物耐受相关基因突变的检测)的精细刻画,将有利于充分发掘CTC在指导临床治疗的价值。
4.3 外泌体检测
外泌体是细胞分泌出的小泡,这个小泡包含的内容非常多,有蛋白质、DNA、信使RNA以及一些非编码RNA,是细胞之间沟通的载体。研究发现肿瘤细胞释放的外泌体的量较大,这些外泌体与肿瘤的发生、发展、转移以及抗药性具有一定的相关性。
外泌体携带的信息多样化,其中的蛋白质和核酸,均可用于癌症的早诊、复发监测、抗药性监测等相关方面的分析。而且外泌体在数量上多于CTC,更易富集;在形式上分泌小泡能够有效保护核酸类物质,克服了ctDNA在血液中容易降解的问题,在临床有较大的应用前景。但是到目前为止,仍没有一种提取方法能同时保证外泌体的含量、纯度以及生物活性。
外泌体的几种分离方法:
离心法:这是目前外泌体提取最常用的方法,此种方法得到的外泌体量多,但是纯度不足,电镜鉴定时发现外泌体聚集成块,由于微泡和外泌体没有非常统一的鉴定标准,也有一些研究认为此种方法得到的是微泡不是外泌体。
过滤离心:过滤离心是利用不同截留相对分子质量的超滤膜离心分离外泌体。截留相对分子质量是指能自由通过某种有孔材料的分子中最大分子的相对分子质量。这种操作简单、省时,不影响外泌体的生物活性,但同样存在纯度不足的问题。
密度梯度离心法:密度梯度离心是将样本和梯度材料一起超速离心,样品中的不同组分沉降到各自的等密度区,分为连续和不连续梯度离心法。用此种方法分离到的外泌体纯度高,但是前期准备工作繁杂,耗时,量少。
免疫磁珠法:泌体相关抗原的抗体(如CD9、CD63、Alix)与外泌体共同孵育,然后分离纯化。这种方法可以保证外泌体形态的完整,特异性高、操作简单、不需要昂贵的仪器设备, 但是非中性pH和非生理性盐浓度会影响外泌体生物活性。
色谱法:色谱法是利用根据凝胶孔隙的孔径大小与样品分子尺寸的相对关系而对溶质进行分离的分析的方法。分离到的外泌体在电镜下大小均一,但是需要特殊的设备,应用不广泛。
外泌体在液体活检中的应用总结:目前有关外泌体的研究,主要集中在外泌体颗粒的提取、纯化和内容物分析上,在临床检测中的应用还不成熟。对CTC、外泌体的检测分析最终还是要落实到标志物数量、蛋白质、DNA、RNA上,蛋白和核酸的分析技术相对成熟,所以问题的关键还是在于如何高效的分离并纯化肿瘤CTC和外泌体。
五、基因测序公司(NGS)的发展方向:测序是起点而不是终点
如果是基因测序产业上游的公司,产品销售的目标客户广泛,横跨科研、医疗、商检领域,产品包括测序仪、DNA提取试剂盒、捕获试剂盒/多重子扩增试剂盒、建库试剂盒、上机测序试剂盒,其中测序仪、上机测序试剂盒两者是绑定的,DNA提取试剂盒、捕获试剂盒/多重子扩增试剂盒、建库试剂盒是可以用第三方的产品,国内企业可以从这三个方向切入,但是试剂盒中的最关键的工具酶以及分离材料等都还是以进口产品为主,壁垒较高,如果能实现这两个产品的进口替代,说明企业具有较强的技术实力。在科研和商检领域,试剂盒的审批门槛较低,但是需要提供定制化服务;在医疗诊断领域,多基因的捕获试剂盒/多重子扩增试剂盒不大可能通过CFDA审批(前面已经说明原因),只有通过认证的临检实验室才能够以自制试剂使用,因此这部分企业(思路迪、世和基因、燃石生物等)需要做两手准备,筹备建设临检中心,向服务端布局。
测序是起点而不是终点,做中游测序服务的机构,最大的市场还是在医疗诊断领域,除了通过提供服务获得收益外,测序机构最大的潜在优势是能够获得特殊患者的组织样本,并且获得基因数据的积累,这对于药物开发是十分便利的条件。比如说,肿瘤患者在使用某靶向药物后出现耐药性,测序机构通过基因测序发现了新的耐药位点(这是PCR、基因芯片这种检测已知突变位点的技术所不具备的优势),那么这个位点就是下一款靶向药物的开发方向,并且测序机构还可以获得患者的肿瘤组织,以此培养原代细胞株,作为药物开发的细胞模型,这就比其他的药物研发机构拥有更多的先发优势。我个人看好思路迪的发展模式,以自己的测序服务为桥梁,打通患者、医院、CRO企业,测序结果提供用药指导,同时反过来链接下游药物开发和临床试验,形成良好的反馈机制。
案例(美国肿瘤测序公司Foundation Medicine):Foundation Medicine是一家专注于肿瘤高通量测序的商业公司,该公司专有的平台可产生对病人的个体癌症可操作的基因组信息,使医生能够在临床实践中优化治疗,使生物制药公司制定有针对性的癌症疗法更加有效。
该公司以二代基因测序技术为基础,根据癌症基因测序结果给肿瘤患者提供精准的用药指南。该公司的基因测序技术能够发现导至患者罹患癌症的基因突变,让“个体化用药”走进了新领域,让医生能够根据患者的遗传信息进行有针对性的癌症治疗。
Foundation Medicine的服务需要医生订购,患者只需提供10余个病例组织切片或者一管几毫升的血液。从提取肿瘤细胞的DNA到最终的报告,持续时间14-21天,其中包含了检测出来的癌症基因突变情况,以及针对每一种突变基因给出的用药指导建议。
Foundation Medicine提供两种产品,FoundationOne和FoundationOne Heme。两种产品均是以二代基因测序为基础,使用的测序仪包括Illumina HiSeq 2000 system和 Life Technologies' Ion Torrent。FoundationOne检测适用于所有实体瘤,检测315个癌症相关基因的编码区域以及28个基因的内含子重排,费用为$5800。FoundationOne Heme检测针对血液恶性疾病、淋巴瘤、白血病等,检测405个基因的编码区序列和31个基因的内含子重排,以及265个基因的RNA序列来检测基因融合,费用为$7200。FoundationOne检测的方法在2013年10月时发表在了Nature Biotechnology上。
进行癌症基因测序检测需要癌症基因的数据库,公司因而建立了数据库FoundationCORE。公司在2014年12月推出了浏览器ICE 2,该浏览器的一大特点是“患者匹配”功能。临床医生可以通过它在已有的知识库FoundationCORE中搜索,寻找与患者肿瘤基因组类似的其他患者的信息。ICE 2的一个新的组成部分是PatientMatch,是一种利用FoundationCORE来增加FoundationOne和 FoundationOne Heme使用率的技术工具。通过PatientMatch,使用ICE 2网络的医生可以与在治疗具有类似基因资料病人的医生相联系,和他们分享诊断结果合治疗方案。根据公司2015年第三季度的报告,FoundationCORE已包含6万个临床病例信息。
Foundation Medicine一直在努力的一个领域是医保问题。2014年,密歇根州的大溪城重点卫生部门宣布把Foundation Medicine的癌症基因组分析服务纳入医保范围;Google表示谷歌公司将该公司的癌症基因的DNA检测服务,作为其员工福利计划的一部分。Foundation Medicine还通过了McKesson诊断交易所和美国国家综合癌症网络的认可,能够对非小细胞肺癌进行全基因组检测,并且收到了独特的Z-code标识符。此外,Foundation Medicine首席财务官Jason Ryan表示,医保范围不仅在肺癌中逐步扩大,还将会逐步涉及到其他疾病服务。
Foundation Medicine的营业收入主要来自两个方面,一个是来自生物制药公司,另一个是来自临床诊断。2015年第三季度,来自生物制药公司的收入为1170万美元,与去年同期相比增长75%;来自临床诊断的收入为1370万美元,与去年同期相比增长40%,营收增长非常明显。