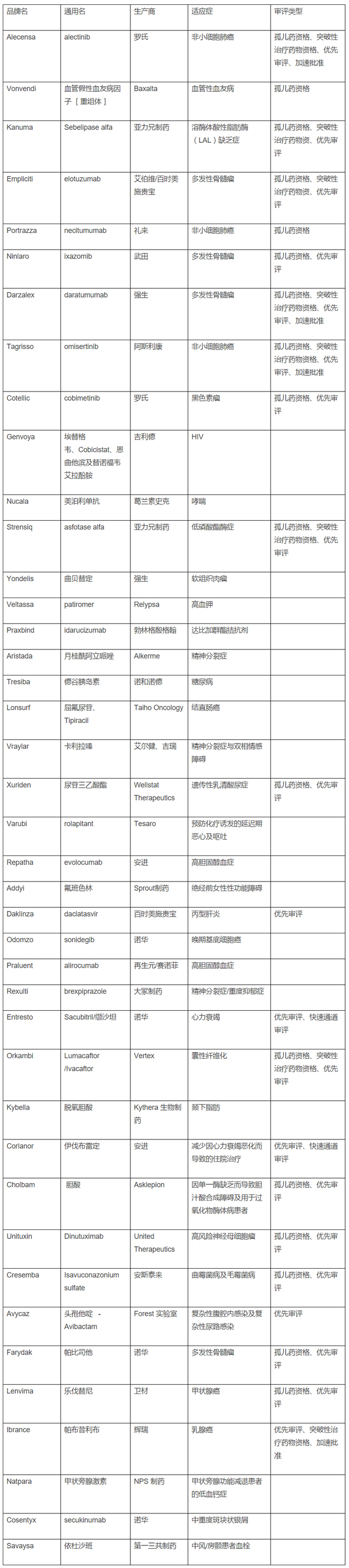
自上周批准三款新药之后,FDA 今年的新药批准数量已达到 43 个,创下 19 年来新药批准的新高。目前为止,FDA 在 2015 年批准的新药总数略逊于 1996 年的 45 个,当时的这一记录是在处方药申请者付费法案刚刚实施 4 年时创下的。
过去 12 个月新药批准的名单透露出广泛的信息,既包含了 FDA 药品监管审评的趋势,也体现了医药行业的健康发展,但最能说明问题的可能是 FDA 最近批准的两款药物,即亚力兄制药的 Kanuma 和 Baxalta 的 Vonvendi,这两款药物均为孤儿药,旨在用于罕见病治疗。
由 FDA 授予孤儿药资格的治疗药物占到了 2015 年新药批准的逾三分之一,这其中包括一些用于患者人群规模相对较小的癌症治疗药物。此外,最近 Kanuma 的获批凸显了 2015 年的另一个重要趋势,优先审评券在日益升值,优先审评券是因成功开发罕见病药物而授予药物生产商的一张快速审评通行证。亚力兄制药现在正手握两张优先审评券,如果该公司选择将其出售给其它公司,这可能证明有高额的利润。
FDA 在批准新的癌症治疗药物上保持了其进取精神,审评的速度与以往相比更快。迄今为止,FDA 在 2015 年批准的癌症新药刚好不到批准新药总数的三分之一,批准的这 13 款癌症新药中,只有 3 个药物未被授予突破性治疗药物资格或一些其它的用来加快审评程序的资格。
FDA 近来批准的多款癌症治疗药物,如阿斯利康的 Tagrisso 和强生的 Darzalex,这些药物的批准均比它们指定的审评截止日期提前数月,而在批准辉瑞帕布昔利布(Ibrance)时更是采用了加速批准,与审评截止日期相比提前了一年,仅基于该药物 2 期试验数据就批准了这款药物。
这些药物的快速批准不仅得益于 FDA 的快速审评,同时也来自于制药公司自身的研发努力,阿斯利康最近批准的 Tagrisso 从第一项临床研究到上市仅仅用了两年零八个月。除了新药,FDA 还显示出对先前已批准癌症治疗药物的适应症扩展授予快速审批的意愿,百时美施贵宝的 PD-1 抑制剂 Opdivo 就是一个最好的例子。
2015 年的新药批准也看到了竞争风险,这种风险在一些市场尤其在加大。例如,FDA 在过去一年批准了四款骨髓瘤新药,包括上个月批准的 3 个。今年最备受期待的两次批准是 PCSK9 抑制剂 Praluent(再生元制药/赛诺菲)和 Repatha(安进)。
这两款药物在一个月内相继进入美国市场,并在他汀药物不能充分治疗的患者中,对高胆固醇的降低有相似的有效性与安全性,而这对于支付者来说是一种利好,他们可通过对两种药物的施压而获得更便宜的药品定价。
Praluent 和 Repatha 均被预测在未来某个时间点会成为重磅炸弹级药物,2015 年批准的新药中,有相当数据的产品可能会产生逾 10 亿美元的销售峰值。
强生的 Darzalex 在临床研究中继续令人印象深刻,与此同时,随着竞争对手 Clovis Oncology 最近披露数据,阿斯利康 Tagrisso 的乐观预期得到提升。在容受了两年的推迟之后,诺和诺德长期等待的基础胰岛素-德谷胰岛素(Tresiba)终于获得批准,同时辉瑞的帕布昔利布第一年上市就报告了一个强大的销售成绩。
从企业的角度来看,诺华在今年是多产的一年,该公司有四款新药获 FDA 批准,超过了其它任何公司。诺华获批的四款新药中,Entresto 和 Cosentyx 有望为这家瑞士公司带来相当大的销售额。亚力兄制药在获批 Kanuma 和 Strensiq 之后,其上市产品的数量增加了两倍,这标志着该公司围绕罕见病治疗药物建立的增长模式将得到一个显著的进展。