
上周对于整个药物临床试验行业是疯狂的一周,CFDA像打了鸡血一般,疯狂发文,更是5家医院因为药物临床试验数据的问题上了榜,大家一片哗然,这是放大招的节奏啊,有人也问笔者,为什么没有推送文章呢?
因为笔者隐隐约约还是感觉到,事情不是解决咯审评积压那么简单,更大的变革还在后面。 最近有个词很流行,叫“原罪”,这个词来源于圣经,意思是人类初始的罪恶行为,如果很多人把医院造假与原罪联系上,那未免也太没有常识了,我们细看从7.22以后,CFDA对整个过程是精心谋划,上周连发的文件,不但将药企的名字、CRO的名字,甚至是医院的名字都公布了出来,并且详细的原因也一并公布,这已经不单单是解决审评积压的问题,更像是一场整风运动。
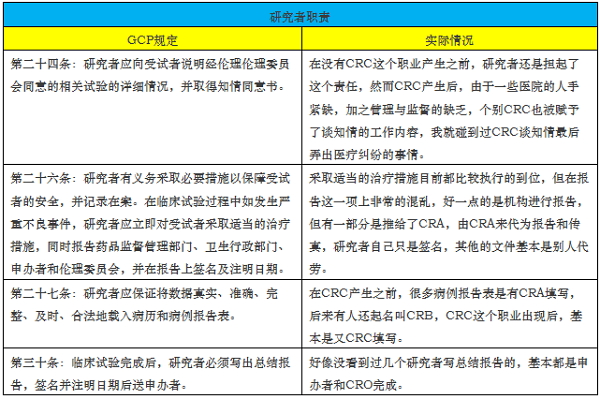
我们还是看一下,CFDA为什么如此大动干戈,《药物临床试验质量管理规范》(简称GCP)可以说是药物临床试验行业的圣经,从第一版到现在也有近20年的时间,然而执行的如何,可以说大家也就遵守了GCP上面提到的流程和文件,而最重要的职责几乎全部跑偏,GCP上一共提到了三部分职责,我们仔细来看看跑偏到什么程度;
这里只列了部分的职责,虽然很多人会觉得不过都是些辅助性的工作,然而我们要很清晰的明白,研究者在这些年的药物临床试验中将很多的本应是自己的职责转移给了机构、CRO、甚至是申办者,这种职责的转移会造成很大的混乱,尤其是出现特殊情况的时候。
申办者的职责我就不详细阐明,基本项目包个CRO后,申办者就只了解各进度,其他的什么事都不管,特别是很多申办者与CRO签那种注册保过的协议,这才是万恶之源。
我们再来看机构,国家设立药物临床试验机构,本身是对医院内的临床试验项目进行管理,质控,以及培训指导研究者,但药物临床试验机构一直在被整个医院的行政管理体系边缘化,在这些研究者的面前话语权较低,无法履行其职责,相反则向CRO、申办者、SMO进行权利挤压,例如,上周某药物临床试验机构的人员要求本院开展的所有所有试验的数据必须得有数据源,甚至是身高、体重、体温、血压,但并不告知研究者,反而催促CRA去与研究者协商,可见该机构的话语权到底有多高。
其实现在我们反观CFDA的动作,可以说是洗牌,而且是大洗牌,不是要洗掉谁(估计也得见点血),让大家已经跑偏了的行为暂停下来,将原来形成的模式解构,重新按照新的游戏规则来办事(也就是新版的GCP),而这个规则是一定要体现出药物临床试验过程中各方的职责,将责权回归到个人的头上,这才是真的大变革。







