
2014年美国FDA药品评价与研究中心(CDER)共批准了41个新药,创1996年以来的新高;其中,包括了11 款生物制剂。如今,2015年已经过去了一大半,在FDA加速审评的基础上,今年上半年制药行业收获如何呢?
据《Nature Reviews Drug Discovery》统计,2015年1月至6月共有14款药物获FDA批准,其中生物制剂有3个,分别是诺华治疗斑块状银屑病的药物Secukinumab、NPS Pharmaceuticals治疗甲状旁腺功能减退的药物Savaysa以及United Therapeutics公司治疗成神经细胞瘤的新药Dinutuximab。
以下是这14款药物的适应症、疗效等详情分析:
2015上半年获FDA批准的14种新药
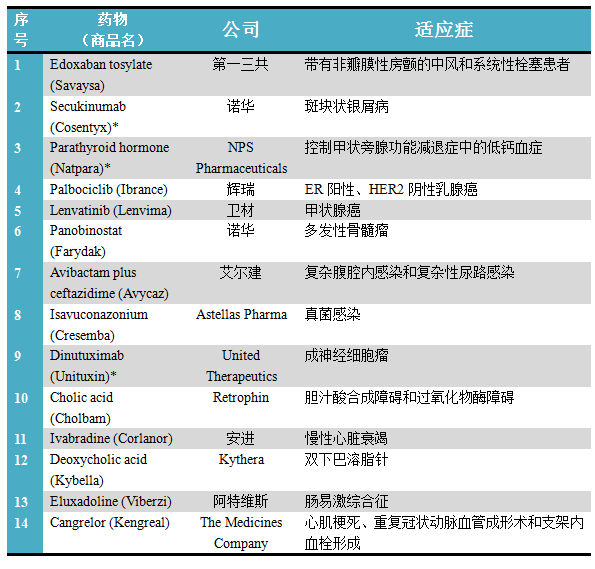
备注:带*的为生物制剂
第一三共:Savaysa
1月8日,美国FDA批准了2015年的第一个新药—第一三共制药公司(Daiichi Sankyo)的抗凝血新药Savaysa(通用名:依杜沙班片,Edoxaban),用于降低非瓣膜性房颤(NVAF)患者中风及系统性栓塞事件的风险。
FDA批准依杜沙班上市主要基于两项积极的3期临床数据。其中一个代号为ENGAGEAF-TIMI的3期临床招募了21105位非瓣膜性房颤患者,另一个Hokusai-VTE实验则在8292位深静脉血栓(DVT)和/或肺栓塞(PE)患者中进行,头对头比较日服一次两个剂量的依杜沙班片和标准疗法华法林相比的疗效和安全性。这些患者之前都接受过五到十天抗凝血药的治疗(注射或输注)。结果发现高剂量的依杜沙班和法华林疗效相当。
诺华:Cosentyx

2015年开年,诺华便迎来了开门红,业界备受期待的重磅单抗药物Cosentyx(secukinumab)几乎同一时间拿下欧美2大主要市场。Cosentyx是全球首个白细胞介素17(IL-17)单克隆抗体,获欧盟和FDA批准用于中度至重度斑块型银屑病(plaque psoriasis)成人患者的治疗。该药的获批,标志着银屑病临床治疗的重大里程碑。在III期临床项目中,Cosentyx相对于安慰剂显著改善了皮肤症状,同时疗效优于另外2种重磅药物:强生的Stelara和安进的Enbrel。
NPS Pharmaceuticals:Natpara
同样在1月,美国FDA正式宣布批准NPS公司开发的罕见病药物Natpara上市。这种注射用药物主要是通过替代人体的甲状旁腺激素来治疗一种名为甲状旁腺功能减退的罕见内分泌紊乱疾病。这种疾病会导致患者钙缺乏和维生素D合成受阻,并最终导致包括肌肉疼痛、骨密度问题等并发症。在一些急性病例中甚至会导致心律失常的后果。
Natpara 的最终获批使得 Shire 公司成为了最终赢家。Shire 公司今年年初以 52 亿美元收购了 NPS 公司以扩充其在罕见病研究方面的实力。而今,NPS 公司已经向其证明了这起收购案的物有所值
辉瑞:Ibrance
2月3日,辉瑞宣布旗下乳腺癌新药Ibrance已获得FDA的加速批准,是全球上市的首个CDK4/6抑制剂。Ibrance是一种口服细胞周期素依赖性激酶4和6抑制剂,其与来曲唑联合使用可作为内分泌治疗基础的初始方案用于治疗ER+/HER2-绝经后晚期乳腺癌。
辉瑞CEO Ian Read 表示第二季度Ibrance一线市场占有率为22%,是第一季度刚上市时的两倍多。在Ibrance的推动下,辉瑞抗肿瘤药物总体销售额将上涨36%。分析师预测Ibrance第二季度销售额将达到7200万美元,但实际销售额达1.4亿美元。辉瑞还计划开展其它实验,研究Ibrance在治疗复杂病症时的疗效。比如,辉瑞正在研究Ibrance对头颈癌及人乳头瘤病毒无关的肿瘤治疗效果。
卫材:Lenvima
今年2月初由日本药企卫材(Eisai)自主研发的新型抗癌药Lenvima(lenvatinib)获FDA批准用于放射性碘难治性分化型甲状腺癌(RR-DTC)患者的治疗。
Lenvatinib是一种口服多受体酪氨酸激酶(RTK)抑制剂,具有新颖的结合模式,除抑制参与肿瘤增殖的其他促血管生成和致癌信号通路相关RTK外,还能够选择性抑制血管内皮生长因子(VEGF)受体的激酶活性。
Lenvatinib的获批,是基于一项III期SELECT研究的积极顶线数据。该研究是一项多中心、随机、双盲、安慰剂对照研究,调查了口服lenvatinib(24mg)治疗放射性碘131抵抗的分化型甲状腺癌(RR-DTC)的疗效。数据表明,与安慰剂相比,lenvatinib使无进展生存期(PFS)得到了统计学意义的显著延长(18.3个月 vs 3.6个月,p<0.0001),此外lenvatinib治疗组有65%的患者肿瘤缩小,安慰剂组数据仅为2%,达到了研究的主要终点。
近日,Lenvima治疗肾细胞癌(RCC)在美国监管方面传来喜讯,FDA已授予Lenvima治疗晚期和/或转移性肾细胞癌(RCC)的突破性药物资格(BTD)。目前,卫材也正在评估lenvatinib用于其他类型肿瘤的治疗,包括肝癌(III期临床)、子宫内膜癌(II期临床)、非小细胞肺癌(II期临床)等。
诺华:Farydak
2月23日,美国FDA批准了诺华的HDAC抑制剂Farydak(通用名:panobinostat)上市,用于和硼替佐米、地塞米松联合使用,治疗之前接受过硼替佐米和一种免疫调节剂治疗但复发的多发性骨髓瘤。Farydak是首个获得FDA批准用于治疗多发性骨髓瘤的HDAC抑制剂。
支持FDA决定的主要是一个含有193位受试者参与的积极临床结果。这些患者之前都至少接受过硼替佐米和一种免疫调节剂治疗过,但又复发的多发性骨髓瘤病人。在这个实验中,Farydak/硼替佐米/地塞米松三联组合治疗组和硼替佐米/地塞米松二联组合对照组相比,无进展生存期(PFS)从对照组的5.8个月延长至三联组合治疗组的10.6个月。应答率也从对照组的41%提高到三联组合的59%。
艾尔建:Avycaz

2月25日,阿特维斯(Actavis,收购艾尔建后,更名艾尔建)宣布,新型抗生素产品Avycaz获得FDA批准,用于复杂性腹腔内感染 (cIAI)(联合甲硝唑)及复杂性尿路感染 (cUTI) 的治疗。
Avycaz(ceftazidime-avibactam,头孢他啶-阿维巴坦)是由一种广谱头孢菌素(ceftazidime)与一种新型β-内酰胺酶抑制剂 (avibactam) 组成的复方产品,开发用于治疗革兰氏阴性细菌感染,包括对现有抗生素产品有耐药性的广谱β-内酰胺酶及肺炎克雷伯杆菌碳青霉烯酶。
Avycaz原本由森林实验室(Forest Lab)和阿斯利康联合开发,但去年2月,阿特维斯耗资250亿美元收购Forest Lab后将Avycaz收入囊中。根据协议,阿特维斯拥有Avycaz在北美市场的权利,阿斯利康拥有Avycaz在全球其他地区的权利。
Astellas Pharma:Cresemba
3月初,FDA周五批准了日本安斯泰来(Astellas Pharma)的广谱抗真菌药Cresemba(isavuconazonium,艾沙康唑),该药主要用于治疗侵入性曲霉病和毛霉菌病,这两种真菌感染多发于血癌患者。
临床试验数据表明艾沙康唑是安全有效的,与伏立康唑(辉瑞旗下抗真菌药,商品名Vfend)相比,病患死亡率更低。Cresemba也获得了FDA QICP (Qualified Infectious Disease Product)认证,这项认证专门用来鼓励传染病领域的抗生素研发,减少细菌或真菌感染。
United Therapeutics:Unituxin
3月10日,FDA批准了United Therapeutics公司的Unituxin(通用名:dinutuximab)上市,作为二线疗法治疗主要发生在儿童的一种罕见癌症—神经母细胞瘤(neuroblastoma)。FDA批准Unituxin的同时也奖给United Therapeutics公司一张罕见儿科疾病优先评审奖券。
Unituxin是一种能和神经母细胞瘤细胞表面结合的抗体。支持Unituxin疗效和安全性的临床实验招募了226例高危神经母细胞瘤的儿童患者。这些受试者被随机分为两组,一组口服维生素A药物isotretinoin(对照组),另一组输注Unituxin和白介素-2、粒细胞-巨噬细胞集落刺激因子(MG-CSF)、以及isotretinoin(联合用药组)。而且这些患者之前都接受过多组合化疗、手术治疗、密集化疗、骨髓移植、和放疗,并且至少表现部分应答。结果发现,3年后Unituxin联合用药组有63%的患者肿瘤没有增大或复发,高于isotretinoin对照组的46%(更新数据分别为73%和58%)。
Retrophin:Cholbam
3 月 17 日,FDA 批准了 Retrophin公司的 Cholbam胶囊。它是获得 FDA 批准用于因单一酶缺乏而导致胆汁酸合成障碍的儿科及成年患者及用于过氧化物酶体病(包括齐薇格谱系障碍)患者的首款治疗药物。Cholbam 作为一种口服治疗药物获批用于三周及以上年龄的儿童及成年患者。
安进:Corlanor
4月中旬,安进公司宣布,公司开发的心脏病药物ivabradine(Corlanor)已经获得了FDA的批准,这也是目前世界上首个以降低心脏病患者心跳速率和住院率的新型心脏病药物。
Ivabradine于去年秋天获得了FDA的专家委员会审核通过,FDA对该药物作出最终决定的日期也早于原定计划。这一结论主要是在公司提交了一项有6500名心脏病患者参与的临床研究基础上作出的。在这项研究中,相对于安慰剂组,ivabradine成功延迟了患者因心脏病病发而首次入院的时间。
不过,尽管ivabradine获得了美国人的认同,但是这种药物在欧洲市场上却引起了不大不小的争论。因为去年安进公司在欧洲进行了一项为期三个月的关于冠状动脉疾病临床研究中,虽然成功将患者每分钟心跳次数降低了10次,但在心脏病死亡率方面未能与对照组产生明显区别。
Kythera:Kybella

4月底,FDA提前2周批准了全球首个“双下巴”溶脂针Kybella(ATX-101),用于中度至重度“双下巴”成人,该针剂是用于消除多余颏下脂肪(双下巴)的首个也是唯一一个非手术治疗产品。ATX-101是一种人造的脱氧胆酸(deoxycholic acid),这是人体内天然存在的一种物质,帮助分解脂肪。在临床试验中,相比安慰剂,ATX-101能够有效消除颏下脂肪并改善整体外观。此次批准,使ATX-101成为同类产品中首个获批用于美容目的的注射针剂。
Kybella的上市,将为“双下巴”人群提供一个高质量的非手术治疗选择,大部分患者注射2-4次后,即可取得满意的效果,少部分患者可能需要注射6次。不过需要注意的是,由于脱氧胆酸能摧毁所接触到的任何细胞,FDA仅批准Kybella用于颏下区脂肪组织,禁止用于其他部位。
据美国皮肤外科学会(ASDS)估计,约68%的美国人受“双下巴”困扰。Kybella作为美容行业一个真正创新的产品,市场潜力十分可观。业界预计,Kybella的年销售峰值将突破3亿美元。今年6月,艾尔健率先看到了Kybella的价值,以21亿美元收购了Kythera。
阿特维斯:Viberzi
5月,FDA批准了瑞士仿制药商阿特维斯(Actavis)用于治疗腹泻型肠易激综合征(IBS-D)的新药Viberzi(eluxadoline)。Viberzi原本由Furiex公司研发,森林实验室(Forest Lab)于2014年7月耗资14.7亿美元将Furiex公司收购;之后,Actavis又耗资250亿美元将Forest Lab收购,将Viberzi收入囊中。
Viberzi是一种首创的口服有效、局部作用治疗药物,具有一种独特的作用机制;该药具有混合的阿片受体活性,是μ受体拮抗剂,也是delta受体激动剂和kappa受体激动剂。在2个III期临床中,相比安慰剂Viberzi能够显著减轻IBS-D患者的腹痛及腹泻症状。然而,该药也具有特定的严重副作用,包括胰腺炎。
The Medicines Company:Kengreal
6月23日,FDA批准了Medicine’s Company的抗血小板注射剂cangrelor上市(商品名:Kengreal),用于避免成人患者在经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)过程中因凝血造成的冠状动脉堵塞。
和其它抗血小板药物一样,Kengreal最严重的风险是大出血,有时甚至危及生命。在一个有1万余人参与的头对头比较Kengreal和Plavix(氯吡格雷)的临床实验中,Kengreal和氯吡格雷相比更能显着降低心肌梗死的发生率,尽管两个组的严重出血事件发生率都比较低,但Kengreal组(1/170)高于氯吡格雷对照组(1/275)。
Cangrelor是P2Y12的可逆抑制剂。最早由英国的一个小公司开发,后被阿斯利康收购。2003年Medicine’s Company从阿斯利康手里收购了Cangrelor的开发权。RBC Capital Market分析师Adnan Butt预计Cangrelor在美国的销售峰值大约8千万至1亿美元。
推荐阅读
FDA approvals in the first 6 months of 2015
特别备注:本文部分药品信息整理自美中药源、生物谷、丁香园等网站







