单克隆抗体是一种广泛用于治疗癌症、炎症、传染病和其它疾病的商业化药物。但是一些科学家认为,尽管这些抗体,如rituximab、trastuzumab和 cetuximab的临床应用非常成功,但是它们所针对的都是单一的靶标,功能依然具有改进的空间。临床研究表明,很多患者不能充分响应单一的疗法,时常出现肿瘤抗药性。单克隆抗体的局限性促使抗体工程师们通过研发两个或两个以上以上的靶标改善和提高这些分子的疗效,增强它们的功能。
通过同时识别两个标靶,双特异性抗体可以作为一个媒介重定向免疫效应细胞,如自然杀伤细胞和T细胞,加强对肿瘤细胞的杀伤功能。此外,通过靶向同一种细胞上的两种不同的受体,双特异性抗体可以诱导细胞信号的改变,包括癌症扩散信号或者炎症信号。
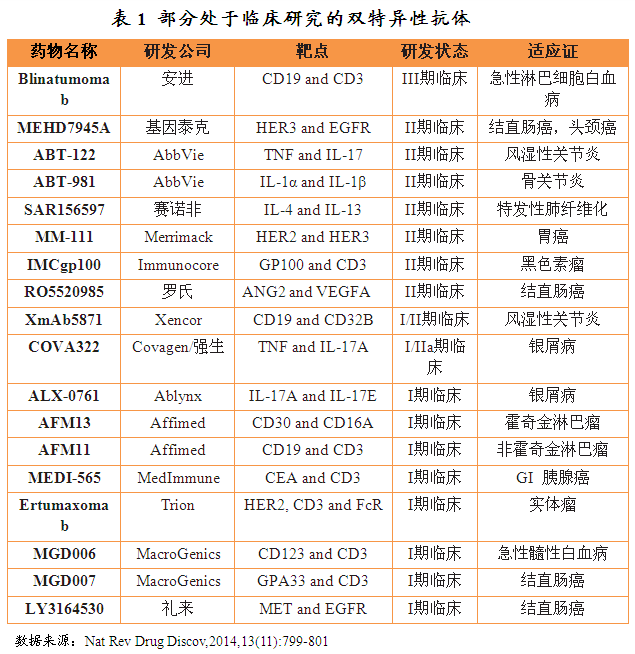
双特异性抗体的治疗潜能引发了很多生物技术公司开展相关的研究,有超过35种双特异性抗体处于临床开发阶段,尚无双特异性抗体通过美国FDA审批上市。
基因泰克
基因泰克(Genentech)的科学家们已经开发出一种让抗体具有两种或两种以上的特异的新方法性。Christoph Spiess博士和他的同事们设计出的这种方法依赖于两种菌株的共同培养,每种细菌表达一半抗体,最后将各自表达的抗体组装成功能性的双特异性抗体。
这种新方法基于最初由基因泰克开发的Knobs-into-Holes技术,该技术是抗体重链有效异源二聚化(heterodimerization)的基础。
Christoph Spiess博士说:“双特异性的想法并不是一个新思路,它与单克隆抗体几乎源自同一时间。但是在20世界80年代,没有技术能够实现这种想法。早期的双特异性抗体是通过共表达两种不同特异性的单克隆抗体。但是当抗体表达时,会产生9种不需要的轻链、重链错配产物。从这些结构相似的抗体中纯化出正确配对的抗体需要很长的时间。”
半抗体细菌共培养途径(half-antibody bacterial co-culture approach)具有很多生产双特异性抗体的优势,可以用于任何已经存在的单抗。这种方法不再有对轻链的需求,也不需要对抗体功能域进行再造。由此产生的双特异性抗体保持着自然的结构,具有良好的药代动力学特性。Spiess博士和他的团队使用这种方法已经生产出了28种双特异性抗体。
安进
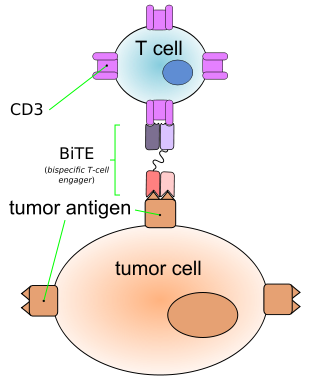
安进公司正准备提交它的BiTE(双特异性T细胞衔接器,bispecific T-cell engager)抗体药物blinatumomab的最新临床数据。该药物同时针对肿瘤细胞表面的CD19抗原和T细胞表面的CD3抗原。安进公司将会在即将举行的美国血液协会的会议上报告审查的结果。
安进公司转化研究的副总裁David Reese表示,会议上会公布Blinatumomab的关键二期临床试验数据,这些数据已经提交给FDA。此前,在2014美国临床肿瘤学会的会议中,已经报道了一部分结果。189名患有复发性或难治性费城染色体阴性急性淋巴细胞白血病(ALL)的患者中有82名(43%)用Blinatumomab治疗后完全缓解,或者对血液复苏完全缓解。在这些完全缓解的患者中有40%接受了干细胞移植。David Reese说:“BiTE研究的一个主要目标就是作为同种异体移植的桥梁。”
今年10月,安进宣布,FDA已经接受了他们blinatumomab抗体生物制品许可申请(Biologics license Application,BLA),用于治疗费城染色体阴性(Ph-)复发性/难治性前体B细胞急性淋巴细胞白血病。此外,FDA还授予blinatumomab优先审查,日期为2015年5月19日。Blinatumomab目前正在开展III期临床试验,如果能顺利通过审批,Blinatumomab将成为第一个通过美国FDA审批上市的双特异性抗体。
罗氏
与此同时,罗氏也表示,他们已经为生产双特异性抗体设计出了一种新的途径,叫CrossMAbs。与其它技术相比,CrossMAbs通过使用一个标准的流程使重链、轻链正确组装,从而产生治疗性的抗体。Christian Klein博士是CrossMAbs的发明者之一,他说:“早在1996年基因泰克公司就发明了能够让不同抗体的重链正确组装的技术,即knob and hole。但是,如何让轻链正确组装仍具有挑战性。”
OncoMed Pharmaceuticals

11月初,OncoMed制药(一家开发靶向癌症干细胞疗法的临床阶段公司)宣布,他们已经获得了用于治疗癌症的anti-DLL4/anti-VEGF双特异性抗体(OMP-305B83)的美国专利(No. 8,858,941)。
OncoMed的CEO Paul J. Hastings表示:“OMP-305B83是一个激动人心的项目。anti-DLL4具有强大的抗癌症干细胞活性和dysangiogenic活性,补充了anti-VEGF的抗血管生成活性,它们将成为抗肿瘤强有力的组合。”公司计划在本月底或者明年年初启动临床试验。
未来机遇
2014年6月Marketwatch发布的一份报告显示,到2023年,双特异性抗体市场将达44亿美元。报告进一步指出,不断进步的技术平台以及增加的风险投资将是推动这一市场增长的动力。此外,由于双特异性抗体结构的复杂性,制药商在该领域有着丰富的机遇。
推荐原文