
46岁的Cecilia Barron此刻和她的儿子正在洛杉矶外的希望之城(City of Hope)癌症研究中心的一间房间里等待着。1小时后,护士会走进来,往她头皮上的肿块注射数百万个T细胞。Barron是Costco的蛋糕装饰师,与丈夫和孩子住在洛杉矶。她从2007年开始治疗脑癌,接受过化疗、放疗和多次手术。在过去的10年里,癌症一直是她生活中不可分割的一部分。
去年夏天,Barron的癌症从第二阶段发展到第三阶段少突胶质细胞瘤。她在希望之城的外科医生Behnam Badie告诉她,她有资格接受一项实验性治疗——改造她自己的T细胞能够识别肿瘤细胞表面抗原的细胞,然后注射进她的大脑。当下,含有这种嵌合抗原受体(CAR) T细胞的疗法已经被批准用于治疗一些血液癌症(如大B细胞淋巴瘤和B细胞急性淋巴细胞白血病),但这种方法在治疗像Barron这样的实体肿瘤上没有那么成功。
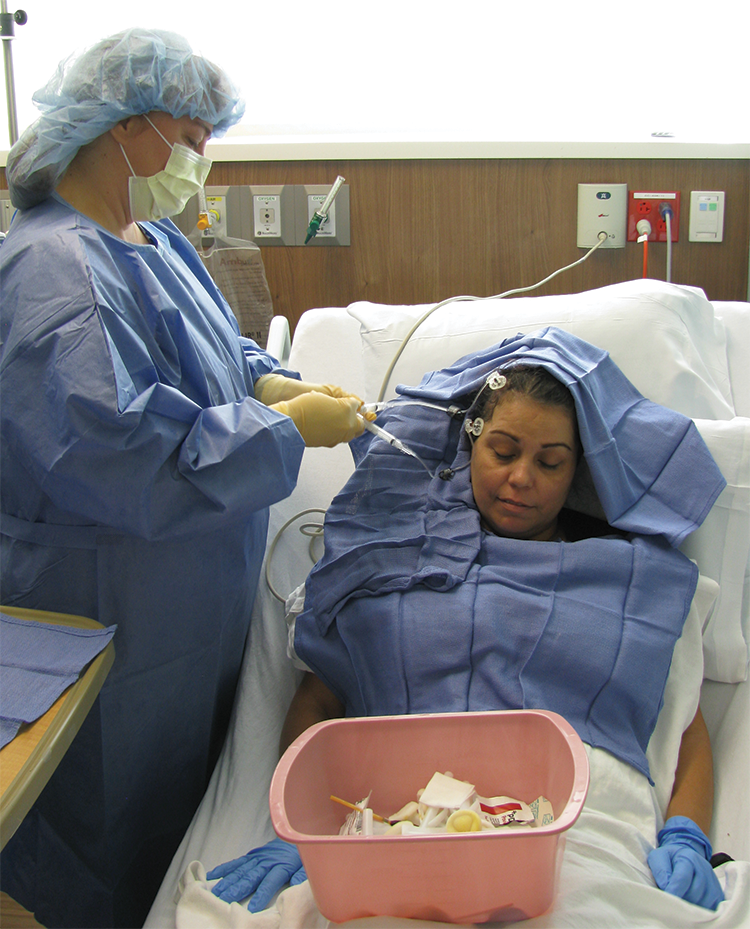
Cecilia Barron
尽管如此,医生们还是希望能找到合适的剂量、CAR构造和补充疗法来发挥作用。“听起来很有希望,” Barron说,“任何事情在没有宣判结束的时候,我都愿意尝试……唯一让我害怕的是针。”
紧接着,Barron坐在病床上,两个护士拿着小瓶T细胞走了进来。其中一个注射到她一个月前被切除的大脑腔,另一个注射到脑室的脑脊液。注入细胞需要几分钟,然后是等待的时间。Barron还需要几个小时才能回家,然后是几周、几个月、甚至更长时间才能看到她的癌症是否会保持平静。
2018年9月,接受CAR-T治疗5个月后,Barron感觉良好,她的核磁共振成像和PET扫描也显示结果非常好。像这样的积极迹象让Barron和其他人乐观地认为CAR-T技术能有效地杀死实体肿瘤,就像某些血液癌症一样。目前已经有一些临床试验处于早期阶段,致力于胰腺癌、间皮瘤、肺癌、乳腺癌等的治疗。
然而,这些肿瘤带来的挑战是血液和骨髓癌症所没有的。首先,实体癌症有着出了名的恶劣环境:酸性、低氧和免疫抑制。这使得T细胞很难浸润并在实体癌块中存活。肿瘤的异质性也意味着所选择的CAR不会与每个肿瘤细胞结合。
贝勒医学院的Nabil Ahmed说,“并不是我悲观,但是实体肿瘤不是白血病。CAR-Ts需要做大量工作,才能显示出这种方法的有效性。”
令人难以置信
Barron是过去几年来在希望之城接受CAR-Ts治疗的数十名脑癌患者之一。这些患有胶质母细胞瘤(又称4级星形细胞瘤)的患者中,有许多人已经用尽了各种办法,面临着严峻的预后。
20年前,癌症生物学家Waldemar Debinski在宾州州立大学发现免疫信号分子白细胞介素13 (IL-13)的受体存在于胶质母细胞瘤中,但不存在于正常的脑组织中。因此,这种受体似乎是一个很好的目标,既能锁定癌细胞,又能保护健康细胞。
2004年5月,希望之城的研究小组将CAR-T细胞直接注射到3个胶质母细胞瘤患者的大脑中。研究人员在患者接受输注的几周内没有观察到明显的不良反应,这是一个重要的成就。因为CAR-T疗法的最大缺点之一就是可能导致严重的免疫过度反应。与此同时,患者的癌症也出现了一些短暂的反应,比如肿瘤死亡的迹象和IL-13丰度的降低。但没有患者痊愈:所有三名患者在接受治疗一年内死亡。希望之城脑瘤CAR-T研究负责人Christine Brown表示,“这让我们在进行更大规模的试验之前,对CAR本身进行了优化。”
具体来说,Brown的研究小组调整了CAR间隔域,这个区域横跨免疫细胞的细胞膜和细胞内的共刺激域,以及用于向体外扩张细胞的过程,以增强T细胞的活性。她说,“我们的CAR细胞比以前强十倍多。在此之前,我们需要输注100多万个T细胞在小鼠体内才能完全消灭。现在我们看到10万个细胞就可以根除。”
2015年,希望之城开始了一项新的CAR-T试验,用这种改良细胞治疗胶质母细胞瘤。第一个接受完整疗程治疗的病人是一位名叫Rich Grady的儿科医生。Brown在叙述Grady的案件时说到,和其他患有这种疾病的病人一样,Grady的癌症在化疗、放疗和手术后复发,到他参加试验时,预计他只能再活几周或几个月。当他的T细胞准备好时,癌症又出现在新的部位,留给他的时间不多了。
在6周的时间里,Grady每周接受一次注射,将他的工程T细胞注射到他的大脑区域。在那里,他的原发肿瘤已经被手术切除。随后的核磁共振扫描显示,虽然原发肿瘤没有生长,但癌症已经出现在他大脑和脊柱的新部位。Badie 的团队决定尝试将这些细胞注入脑脊液,希望它们能够分散并追踪到身体其他部位的肿瘤。
Badie 说,他永远不会忘记,在Grady接受了几次脑室内注射后,做了第二次核磁共振扫描的那一刻——肿瘤(包括原发肿瘤和新发病灶)均已缩小。10次全过程输注后,均未发现肿瘤。
“真是难以置信,”Badie 说。他本以为自己会给Grady带来和大多数胶质母细胞瘤患者一样的坏消息——癌症正在取胜,他和家人只剩下几个月的时间了。但是CAR-T细胞疗法似乎已经摧毁了不知疲倦的癌症。
Brown进一步说到,更重要的是,Grady的癌细胞并不全部显示出CAR所针对的IL-13受体,这表明经过改造的T细胞帮助了Grady的免疫系统与癌症作斗争。我们认为CAR T细胞就像一个火花,点燃了内源性免疫反应。她补充道,“不幸的是,这还不够,因为该死的肿瘤复发了。” Grady于2017年4月25日去世。
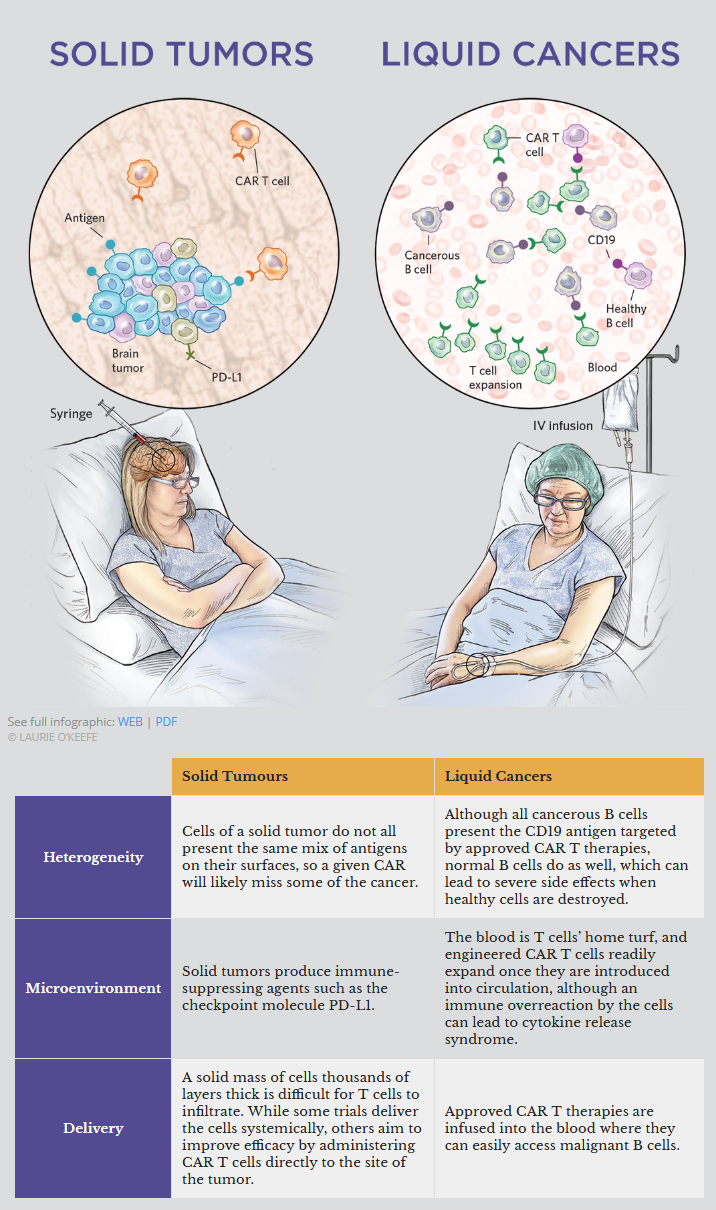
递送的挑战
尽管Grady没有在肿瘤复发中存活下来,但他在试验期间的积极反应表明,可以使用CAR-Ts杀死胶质母细胞瘤,这使得希望之城的研究人员建立了双导管方案。这种方案中,Barron和其他患者都是注射到肿瘤部位和心室。
CAR-T递送是实体肿瘤治疗中的一个复杂因素。对于血液癌症,细胞是通过输注血液来控制,一旦进入血液循环,CAR-Ts就能发现并摧毁这些异常细胞。对于实体肿瘤,就没那么简单了。“CAR-T治疗确实需要细胞间的相互作用,这是更可能发生在循环肿瘤细胞而非实体肿瘤,” Mustang Bio的总裁兼首席执行官Manuel Litchman说道。Mustang Bio是一家赞助了部分希望之城的脑癌CAR-T试验的生物技术公司,并正在开发自己的淋巴瘤CAR T细胞疗法。
有可能对实体肿瘤进行全身性的CAR-Ts输注,它们可以穿过血脑屏障进入大脑,也可以迁移到身体的其他部位。例如,贝勒医学院(Baylor College of Medicine)的Ahmed团队给19名患者进行了全身性输注CAR-Ts的治疗,这些患者都是多次复发的儿童或年轻人。CAR-T的作用是靶向HER2受体。几个月后,研究人员在肿瘤中发现了低频率的CAR DNA,这表明一些工程化的T细胞已经到达了那里。
虽然大多数患者最终还是死亡,平均存活时间只有10个月,但其中4人现在是长期幸存者。“我们认为这是一个非常有趣的信号,” Ahmed说,“我们正在努力理解,这四个人有什么不同?”
在一项后续研究中,Ahmed和他的同事们正在尝试通过延长CAR-T细胞在体内的存活时间来让更多的CAR-T细胞到达肿瘤部位。他们之前观察到CAR-T在几周到几个月内就会消失。但一些数据表明,反复注射可以延长细胞在体内的存活时间,从而有助于抑制复发。另一种方法是鼓励细胞在注射后增殖。这一次,Ahmed和他的同事们首先进行化疗,破坏患者的淋巴细胞,希望能鼓励CAR-T细胞扩大并填补免疫真空。
不过,宾夕法尼亚大学佩雷尔曼医学院(Perelman School of Medicine at the University of Pennsylvania) CAR-T研究人员Steven Albelda表示,要把足够多的工程T细胞递送到实体肿瘤部位仍然是一个挑战。在动物模型中,通过静脉注射,进入肿瘤的细胞数量非常非常少。这使得他的研究小组和其他研究人员转向局部注射细胞,就像Grady和Barron那样。Albelda的小组正在进行一项试验,病人将在肺周围胸膜中接受细胞,以治疗生长在那里的癌症。
纪念斯隆凯特琳癌症中心的Prasad Adusumilli是该地区第一个在胸腔输注CAR -T治疗的癌症患者。Albelda和他的同事们发现,局部输送T细胞比静脉输送更有效地清除小鼠体内的肿瘤,而且这些细胞停留的时间更长。这些结果使研究小组开始了一项针对肺癌、间皮瘤(肺内膜癌)或乳腺癌患者的临床试验。
到目前为止,他们已经治疗了23名患者,治疗似乎是安全的。这只是一个早期的试验,旨在评估安全性,但有很好的迹象表明它是有效的。通常情况下,在这项试验中患有这种疾病的患者的寿命大约为1年。但是后续的PET扫描显示肿瘤内部和周围的代谢活动正常。研究人员说,“在我们的试验中,我们的患者有1年的完全代谢反应。这些结果是无与伦比的。”
即使是直接输注,研究人员也观察到多次CAR-T注射可能比一次注射更有效。西雅图儿童医院研究所的儿科神经科学家Nicholas Vitanza表示赞同。他正在领导两项临床试验,测试脑癌患儿直接输送CAR T细胞:当T细胞在其原生血液环境中茁壮成长时,在实体肿瘤环境中可能需要一些帮助。他说,“与白血病不同,我不相信我们在大脑中有相同的扩张,所以我们给予不同的剂量。”
趋于完美的CAR-T
正如单剂CAR-Ts不太可能彻底清除实体肿瘤一样,设计成针对特定目标的单剂CAR-T可能也不够。尽管这样的策略在血液肿瘤中是有效的,当下已有两种被批准的CAR–T, tisagenlecleucel (Kymriah)和axicabtagene ciloleucel (Yescarta)。但针对实体肿瘤,追逐产生CD19的细胞变得更加复杂。
问题是双重的。首先,实体癌症是异质性的。与CAR-T靶向的癌症B细胞不同的是,并不是所有的实体肿瘤细胞都携带CAR T设计用来攻击的抗原。其次,即使单目标CAR-T能够成功地根除肿瘤,肿瘤有时也会在摆脱抗原后复发。Rich Grady就是这样。希望之城的Brown说,当Grady的肿瘤在他开始CAR - T注射7个多月后复发时,肿瘤中没有太多的靶向抗原。因此,在部署CAR-Ts时,可能需要针对多个抗原。
抗原靶点的选择是CAR-Ts发挥作用的关键。为了避免危险的副作用,开发人员必须制造出一种CAR-T,它可以选择性地攻击癌细胞,同时保留健康组织。这对于CAR-T治疗血液恶性肿瘤是一个挑战,因为正常的B细胞也携带CD19抗原。因此,这些干预措施可能导致免疫球蛋白产量下降,使患者面临严重感染的风险。对于实体肿瘤,研究人员有机会选择真正的癌症特异性靶点,即所谓的新抗原。例如,宾夕法尼亚大学的免疫学家和肿瘤学家Carl June的团队正在开发一种针对胶质母细胞瘤细胞表皮生长因子受体(EGFR)的CAR。具体地说,他和他的同事们设计了这种受体来结合一种剪接变体,这种变体在人体其他任何地方都找不到。
即使研究人员找不到癌细胞特有的抗原,他们也可能能够识别出肿瘤中比健康组织中丰富得多的靶点。在宾夕法尼亚大学,Albelda和他的团队正瞄准间皮素(间皮素被各种癌症过度产生,包括间皮瘤、胰腺、卵巢和一些肺癌)。在两项早期试验中,该疗法避免了这些癌症患者的脱靶毒性。(推荐阅读:AACR两项早期研究:CAR-T疗法在实体瘤中展现出潜力https://www.biodiscover.com/news/research/733646.html)
组合疗法的CAR-Ts
现在,许多临床试验已经证明,CAR-Ts可以安全地应用于实体瘤患者。几乎所有从事这些实体肿瘤免疫治疗的研究人员都在选择采取多种药物,无论是药物组合、分泌免疫增强剂的CAR-T,还是设计用于CAR的T细胞。“我认为我们可以永远测试单剂一期试验,但永远不会改变任何东西,因为实体肿瘤过于复杂,细胞亚群太多,”Vitanza说。
临床试验中出现的一种组合是CAR-T和另一种叫做检查点抑制剂的免疫疗法。CAR-T细胞不仅面临着进入、存活和扩张的障碍,还面临着所谓的免疫检查点的挑战——在癌症中可以上调免疫干扰通路。目前已经有一些被批准的检查点抑制剂药物,比如针对内源性T细胞上各种检查点蛋白的单克隆抗体,它们可以消除这些信号,研究人员现在开始将这些药物与CAR - T疗法结合起来治疗实体肿瘤。
参考资料
The Next Frontier of CAR T-Cell Therapy: Solid Tumors
Receptor for interleukin 13 is a marker and therapeutic target for human high-grade gliomas,” Clin Cancer Res, 5:985–90, 1999.
C.E. Brown et al., “Bioactivity and safety of IL13Rα2-redirected chimeric antigen receptor CD8+ T cells in patients with recurrent glioblastoma,” Clin Cancer Res, 21:4062–72, 2015.
C.E. Brown et al., “Regression of glioblastoma after chimeric antigen receptor T-cell therapy,” New Engl J Med, 375:2561–69, 2016.
N. Ahmed et al., “Human epidermal growth factor receptor 2 (HER2)–specific chimeric antigen receptor–modified T cells for the immunotherapy of HER2-positive sarcoma,” J Clin Oncol, 33:1688–96, 2015.
P.S. Adusumilli et al., “Regional delivery of mesothelin-targeted CAR T cell therapy generates potent and long-lasting CD4-dependent tumor immunity,” Sci Transl Med, 6:261ra151, 2014.
P.S. Adusumilli et al., “A phase I clinical trial of malignant pleural disease treated with regionally delivered autologous mesothelin-targeted CAR T cells: Safety and efficacy - A preliminary report,” American Society of Cell & Gene Therapy 21st Annual Meeting, Chicago, May 17, 2018.
L. Cherkassky et al., “Human CAR T cells with cell-intrinsic PD-1 checkpoint blockade resist tumor-mediated inhibition,” J Clin Invest, 126:3130–44, 2016.
O.O. Yeku et al., “Armored CAR T cells enhance antitumor efficacy and overcome the tumor microenvironment,” Sci Rep, 7:10541, 2017.
B. Hu et al., “Augmentation of antitumor immunity by human and mouse CAR T cells secreting IL-18,” Cell Rep, 20:P3025–33, 2017.







