本文转载自“医麦客”。

在细胞治疗作为全球制药巨头新宠的大背景下,完全个性化的治疗方式似乎已经满足不了广大患者的需求了。耗时耗力以及高昂成本的问题让公司承担不来,患者无福消受。因此在这项革命性技术突破的前夕,如何将细胞疗法变成一种规模化的治疗方式,达到所谓的“off the shelf(即用型产品)”才是我们要解决的大问题。
今天,小编盘点了细胞疗法领域未来有可能实现真正的“off the shelf”的各项突破性技术。
筹集1.2亿美元,将红细胞现成疗法带入临床

近日,不差钱的Rubius Therapeutics因其公司独特的红细胞现成疗法筹集到了1.2亿美元,旨在将这项突破性技术带入临床。
位于马萨诸塞州,剑桥的Rubius Therapeutics是在Flagship VentureLabs孵化的突破性治疗平台。该公司的研发管线是建立在生物反应器中大量生产和将红细胞武器化的途径上,其独创的红细胞治疗技术Red-Cell Therapeutics(简称RCTs),在癌症以及罕见病方面都展开了应用性研究。由于这项红细胞疗法具有可规模化生产的特征,所以一旦临床进展顺利,其商业化就不存在什么大问题。(2015年,Rubius Therapeutics公司曾被《Nature 》评为最牛的八个学院派生物技术创业公司之一)
那何为RTC(红细胞治疗)呢?
众所周知,随着基因工程技术的日益成熟,将基因编辑技术用于癌症治疗似乎已经不算什么难事了。然而,对基因编辑技术持有戒备心的研究人员,仍然对遗传物质被改造过的细胞作为治疗药物持怀疑态度。
那有没有这样一种可能性:在使用基因编辑技术的同时,能够阻止被改造过的遗传物质进入人体。其实今天介绍的Rubius独创的红细胞治疗技术Red-Cell Therapeutics(简称RCTs)就符合这个要求。
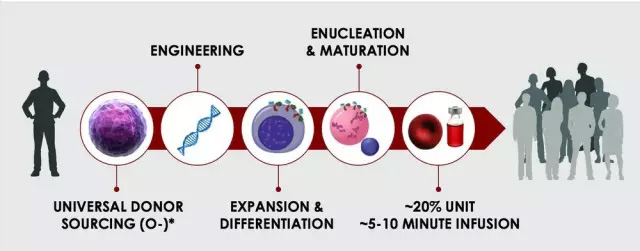
RTC-红细胞治疗(图片来源Rubius官网)
首先确定治疗疾病所需的蛋白药物,然后将该蛋白对应的基因插入到干细胞的基因组里面;将改造好的干细胞放在一定的条件下培养,诱导它变成红细胞,并开始合成蛋白药物;最后,红细胞前体将细胞核“弹射”到胞外。
此时细胞内没有遗传物质,但是药物还在;将携带蛋白药物的红细胞输回患者体内,就可以进行治疗了。因为Rubius公司研发的RCTs技术巧妙的利用了红细胞成熟过程中会舍去细胞核的特征,所以研究人员就不用担心遗传物质在经过基因编辑之后带给人体的安全隐患。
而且理论上来说,这项技术可以根据患者的需求,生产出各种各样的具有治疗功能的红细胞。基于此,Rubius总裁Torben Straight Nissen博士表示:“我们已经能够在红细胞上表达共刺激分子以及被用于免疫肿瘤学的其他相关蛋白质了。
携带共刺激分子和检查点抑制剂的这种组合的红细胞可以在抑制肿瘤逃避监测的能力的同时充分激活T细胞,从而使免疫系统对肿瘤进行攻击。而且我们的技术不需要结合这些类型的其他疗法,因为我们可以在红细胞上表达它们。现如今我们的每个产品几乎都有一个研发管线。”
不得不说,这项黑科技在治疗实体肿瘤和血液癌症及其在癌症以外疾病中的应用的潜力巨大。而且值得我们注意的是,这项技术可以使细胞疗法变成一种规模化的现成治疗(off the shelf)方式。
基于纳米技术的CAR-T疗法

时至今日,几乎已经听不到对CAR-T疗法的质疑了。大家现在最关心的是,这个治疗过程极其复杂的疗法究竟如何落地,让更多的普通患者受惠。毕竟目前的治疗过程对于一些病人来说也是耗时且昂贵的。来自Fred Hutchinson 癌症研究中心的Matthias Stephan博士另辟蹊径,在CAR-T治疗历史上第一次实现在体内构建CAR-T细胞。
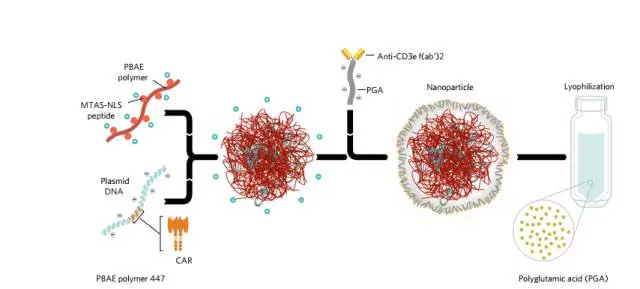
携带CAR基因的纳米颗粒制作流程(图片来源 Nature杂志)
在这项新的研究中,Stephan和他的团队开发出了可传递CAR编码基因的生物可降解的纳米颗粒,并利用分子标记,使其像毛刺一样粘附在T细胞上。
据Stephan博士报道,他们可以将这种改造T细胞的纳米颗粒制成冻干粉,装在玻璃瓶内,使用时只需溶解注射即可。一旦完成静脉注射,纳米颗粒会特异性与T细胞结合,而不侵扰其他的细胞。纳米颗粒被T细胞吞噬后,编码CAR的基因在引导下,进入T细胞核。在这里,CAR基因编码CAR,并把特异性识别癌细胞的CAR装在T细胞表面,使其成为“特种兵”CAR-T细胞。在小鼠模型体内,Stephan博士发现经过纳米颗粒体内改造的T细胞可以在24到48小时内产生CAR。
携带CAR基因的纳米颗粒可以产生与目前采用的CAR-T疗法类似的抗癌效果。这将会给癌症患者提供更温和、更便宜和更简单的免疫治疗。而且由于纳米粒子廉价且易于生产,Stephan相信这会成为像Keytruda或化疗药物那样易于存储和实施的治疗方法。Stephan博士表示他们正在结合所有技术的优点,不久之后,纳米粒子可以使细胞免疫治疗成为“在癌症确诊之日,病人就可以在生活附近的门诊进行这种治疗。”从而实现CAR-T疗法的“off the shelf”。
基于同种异体方法开发的CAR-T疗法

2015年11月Cellectis的CAR-T细胞株,成功挽救了身患白血病的1岁小姑娘Layla的生命,世界为之震动。之所以会引起社会的极大关注,是因为Cellectis的CAR-T细胞株不同于传统的CAR-T疗法。
Cellectis公司通过使用用TALEN基因编辑技术“关闭”导致人体排异反应的基因,将CAR-T制备成UCART(通用CAR-T)。这种利用同种异体方法(allogeneic)开发而成的CAR-T疗法,不需要依据患者进行相应的修饰,而是直接将来源于非患者(non-patient) 供体的T细胞进行工程化,可用于多个患者的治疗。
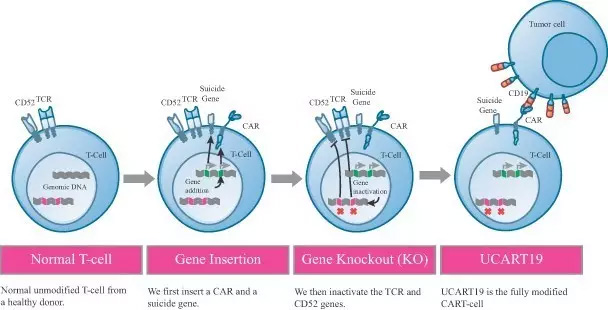
Manufacturing process (图片来源 Cellectis官网)
该方法与自体移植的CAR-T方法不同,后者是将来自患者自身的T细胞进行工程化,用于患者自身肿瘤的治疗,包括诺华、Kite制药、Juno在内的均采用的是自体移植方法。除了耗时费力,传统的CAR-T疗法还面临着治疗费用昂贵,以及极度个性化带来的难以标准化等问题。
相比较而言,UCART的治疗过程就相对简单的多,治疗费用也更低,这使得Cellectis在CAR-T领域拥有了巨大的优势。
目前,FDA已经同意了Cellectis公司的通用型CAR-T疗法UCART19在复发或难治性急性淋巴细胞白血病患者中开展临床研究的新药研究申请(IND),另一候选产品UCART123也已经获得了美国FDA研究型新药一期临床试验批准,如果UCART的后续临床试验证明其安全有效,那么定将解决细胞药物工业化难题,从而做到真正的“off-the-shelf”。相信Cellectis公司凭借着传统的CAR-T疗法无法比拟的优势一定会后来居上。
新基因编辑技术开发的通用CAR-T

PoseidaTherapeutics是一家位于美国加利福尼亚州、圣地亚哥的生物技术公司,其致力于将最佳的基因编辑技术转化为挽救生命的治疗药物。
该公司的研究人员利用其公司专有的基因编辑工具Next GEN CRISPR,开发出了一种通用的供体CAR-T细胞疗法,这种方式可以有效避免身体的排斥反应和CAR-T细胞的过早耗竭,解决了阻碍“off the shelf”CAR-T细胞疗法发展的两个关键问题。
相比较传统的CAR-T细胞产品的生产方式,通用供体CAR-T产品的开发可以显著降低成本,同时有可能实现对全球任何血液病和实体瘤患者的治疗。”另外,自体CAR-T细胞治疗由于免疫抑制肿瘤微环境的存在,针对实体瘤的相关临床进展的并不是很顺利。对此,科学家们正在通过多种基因编辑技术,以寻求解决上述问题的方法。
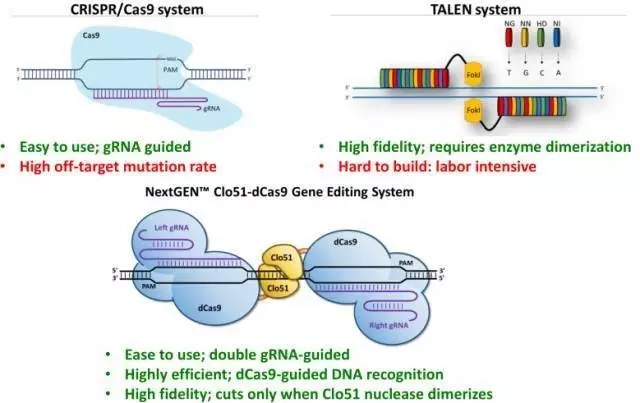
TALEN、CRISPR/Cas9、NextGEN CRISPR (来源于Poseida官网)
相比TALEN技术只能用于激活的细胞的使用限制性,CRISPR/Cas9由于可能的脱靶突变也存在着潜在的生产上的安全风险。而Poseida公司的新型的混合基因编辑系统 NextGEN CRISPR就可以在解决脱靶突变的同时克服静息T细胞的编辑限制。
其用于开发同种异体CAR-T产品,通过要求同时和空间绑定两个对现场生产性编辑事件至关重要的半站点组件来实现高保真度。使用NextGEN CRISPR产生的同种异体CAR-T细胞既不反应也不被不匹配的同种异体T细胞排斥,这展示了一个真正的同种异体CAR-T产品的制造。此外,基因编辑的CAR-T细胞完全能够杀死肿瘤细胞,并表现出高度有利的干细胞记忆表型(TSCM),这被认为可能是治疗患者癌症复发的持续控制的关键。
新型DC细胞疫苗靶向实体瘤

Immunicum是位于瑞典哥德堡的一家生物技术公司,专注于肿瘤免疫治疗。它与大多数公司采用不同的方法,即不是采用T细胞,而是将DC细胞进行工程化改造,从而避免T细胞治疗如CAR-T细胞的高毒性风险。
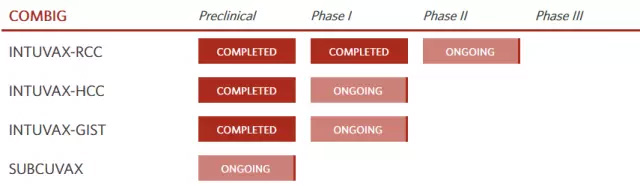
研发管线(图片来源 Immunicum官网)
Immunicum拥有独特的技术平台—Intuva。Intuva是来自健康供体的、活化的DC细胞产品,然后通过介入手段注入肿瘤。其治疗的关键之处在于,一旦Intuva被注射到肿瘤中,这些改造过的DC细胞可以招募患者自己的免疫细胞,后者可以对每个肿瘤的新生抗原产生免疫反应。
通过使用同种异体细胞来代替自体移植的现成疗法(off the shelf),可以容易地扩大制造规模、降低制备成本。在毒性方面,Intuvax到目前为止没有在任何治疗的患者中显示发生不良反应。然而,其最值得关注的特征是,在理论上,该策略可以应用于治疗任何可注射的实体瘤。这是一个意义重大的技术,因为靶向实体瘤仍然是肿瘤免疫治疗中的一个巨大挑战,而大多数新型免疫细胞治疗技术主要都专注于治疗血液肿瘤。
精准预治的γδT细胞免疫疗法

以色列GCT(Gamma Cell Tech)是一家从事生物医疗技术研发的公司,致力于开发γδT细胞免疫疗法及治疗平台。其中包括开发第一个“off the shelf(货架产品)”,即“同种异体”的T细胞。
γδT细胞免疫疗法是通过提高增强患者自身抵抗癌细胞和病毒感染的能力来达到治病的目的。但与其它细胞免疫疗法不同的是,γδT细胞免疫疗法是一种“精准预治”细胞免疫疗法—即它自带“智能导航系统”,能提前识别并杀灭癌细胞,这是目前其它细胞免疫疗法做不到的(这些疗法要么无法识别癌细胞,要么须外增靶向性来辅助识别癌细胞,增加了治疗的难度、价格及风险)。
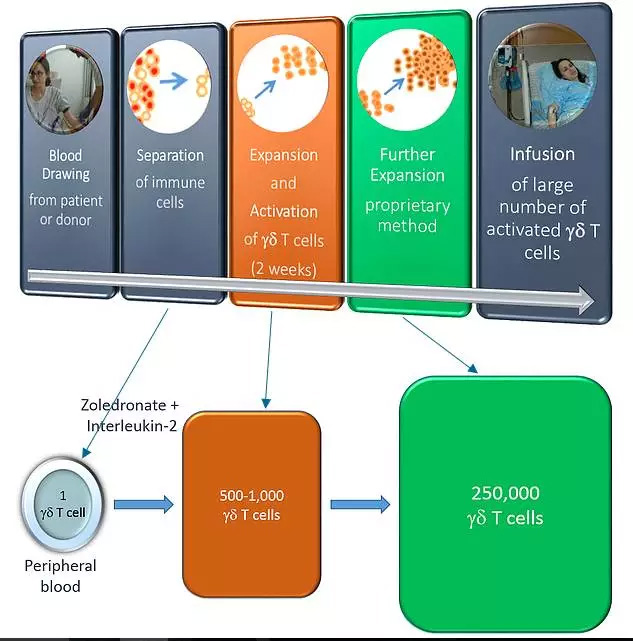
下一代γδ免疫治疗技术(图片来源 Gamma Cell Tech官网)
GCT开发的第一个“off the shelf”产品意味着γδT细胞不仅可以从患者自体提取扩增,还可以从其他的健康供体(比如患者的亲属甚至其他人)提取扩增来供患者使用,并且没有排异反应,因此可实现“大规模生产并放在货架上销售的细胞产品”,大大降低单位疗程价格,提升治疗效果,免除患者的后顾之忧。
结语
我们所知道的“细胞疗法”一直被称作是一种“个体化治疗”,顾名思义,就是个性化定制,为患者打造专属的治疗方式。可想而知价格不菲。就像世界上第一个癌症疫苗Provenge的研发公司 Dendreon之所以最终破产,一定和它高成本的“个体化生产”方式有着密切的关系。所以说细胞疗法的抗癌战场上,做到“off the shelf”这一步才是王道。一旦可以实行工业化生产,细胞免疫疗法的费用就会大大降低。
在细胞治疗日益发展的这个时代,包括其CAR-T疗法即将走向上市阶段的诺华和Kite等公司在内,已经意识到了规模化生产的这个问题。而且与此同时,很多公司也在致力于开发“off the shelf”产品,我们有理由相信,在不久的将来就可以看到人类医疗史上最高逼格的医药形式—“Off the Shelf”。
参考资料
Rubius Erythrocyte Design (RED)™ Platform
https://www.gammacelltech.com/
https://www.cellectis.com/en/products/
In situ programming of leukaemia-specific T cells using synthetic DNA nanocarriers







