4月10日-15日,2021 AACR以虚拟会议的形式召开。截至目前,百济神州、信达生物、亚盛医药等多家本土生物制药企业已经在会上分享了旗下产品的临床前和临床数据,为实体瘤和血液肿瘤带来了更多的潜在治疗选择。
其中,一些疗法已完成3期临床,步入上市审批阶段,距离推向市场仅一步之遥。
肺癌
公司:信达生物
产品:达伯舒®
适应症:晚期鳞状非小细胞肺癌
阶段:3期临床试验数据
此次信达生物带来了一项研究达伯舒®(信迪利单抗注射液)对比多西他赛用于晚期鳞状非小细胞肺癌(sqNSCLC)二线治疗的随机、开放、多中心、平行对照3期临床研究。近20年来,该疾病领域的药物进展较为迟缓,因此这项研究的重要性不言而喻。
在280例一线含铂化疗治疗失败的受试者中,信迪利单抗对比多西他赛显著延长了患者的总生存期(OS),达到主要研究终点。具体而言,信迪利单抗组和多西他赛组的OS分别为11.79和8.25个月,由研究者评估的中位无进展生存期(PFS)分别为4.30和2.79个月,确认的客观缓解率(ORR)分别为25.5%和2.2%。
公司:贝达药业
产品:甲磺酸贝福替尼
适应症:非小细胞肺癌
阶段:2期临床试验数据
2021 AACR现场,贝达药业带来了旗下新型三代EGFR-TKI甲磺酸贝福替尼用于既往接受过一/二代EGFR-TKI治疗后产生耐药且EGFR-T790M突变阳性的局部晚期或转移性NSCLC患者的2期临床试验数据。
在290例接受了75-100mg剂量的参与者中,188人经独立评审委员会(IRC)评估确认为部分缓解(PR),ORR为64.8%,疾病控制率 (DCR) 为 95.2% 。在34例基线有脑转移的患者中, 18例经IRC评估确认为PR ,颅内客观缓解率(iORR)为52.9%,颅内疾病控制率(iDCR)为97.1%。最常见的不良反应为血小板减少症(57.2%)、头痛(27.6%)、白细胞计数降低(23.4%)、贫血(22.1%)、皮疹(20.7%)。
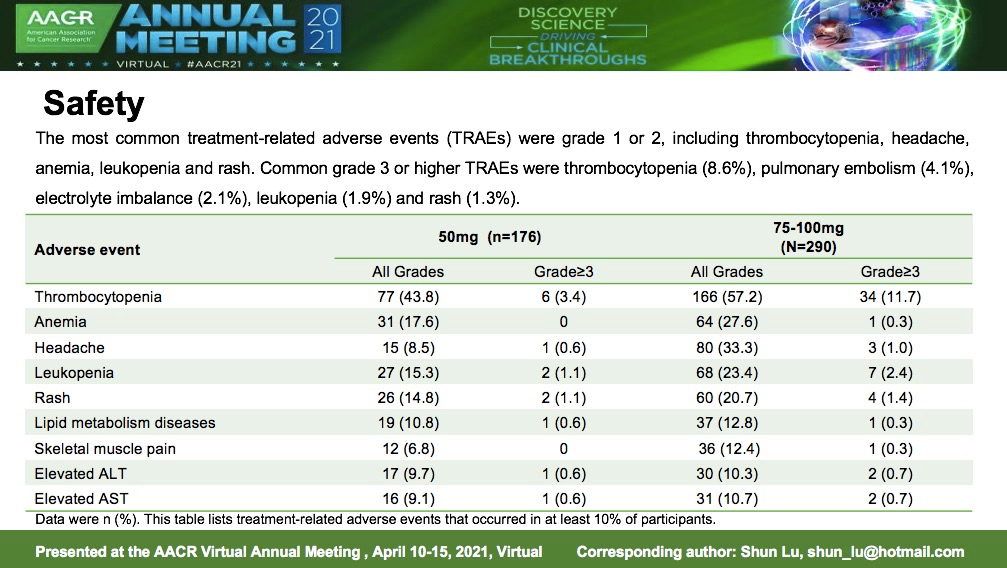
图片来源:贝达药业官方微信
公司:百济神州
产品:百泽安®
适应症:二/三线非小细胞肺癌
阶段:3期临床试验数据
在2021AACR现场,百济神州公布了其抗 PD-1 抗体百泽安®(替雷利珠单抗)对比多西他赛针对二线或三线局部晚期或转移性非小细胞肺癌(NSCLC)患者的全球 3 期临床试验RATIONALE 303的中期分析结果。
与多西他赛相比,百泽安®将患者的中位OS延长了近6个月(17.2 vs 11.9)。在PD-L1高表达患者中,经百泽安®治疗后的患者中位OS为19.1个月,多西他赛试验组为11.9个月。在次要结果方面,百泽安®治疗组的中位PFS为4.1个月, ORR为21.9%,中位缓解持续时间(DoR)为13.5个月,而多西他赛试验组的患者的中位PFS则为2.6个月,ORR为7.0%,中位DoR为6.2个月。在12个月内,百泽安®治疗组的PFS概率为23.3%,多西他赛试验组则为5.7%。
3月5日,百泽安安基于这项试验结果的新适应症上市申请已在国内获得受理,目前正在接受审评。
乳腺癌
公司:康宁杰瑞
产品:KN046联合白蛋白紫杉醇
适应症:三阴乳腺癌
阶段:1b/2期临床数据
4月13日,康宁杰瑞以壁报形式公布了PD-L1/CTLA-4双特异性抗体KN046联合白蛋白结合型紫杉醇治疗晚期三阴乳腺癌患者的1b/2期临床研究数据。
这项研究纳入了25例可评估的初治局部晚期不可切除或转移性三阴乳腺癌女性患者数据,中位随访时间为13.7个月。接受联合疗法后,患者ORR为40.0%,DCR为96.0%。意向性人群的PFS为7.3个月,意向性人群的15个月OS率为73.4%。在PD-L1阳性患者中,中位PFS为13.8个月,15个月的OS率为77.1%(95%CI:34.5~93.9%)。
公司:亚盛医药
产品:APG-2575与Palbociclib联用
适应症:ER⁺乳腺癌
阶段:临床前试验数据
内分泌治疗和细胞周期蛋白依赖性激酶4/6抑制剂(CDK4/6i)联合治疗是早期转移性ER⁺乳腺癌标准治疗方案,然而多数患者仍不可避免耐药复发。
临床前数据显示,FDA批准用于ER⁺乳腺癌治疗的CDK4/6抑制剂Palbociclib能够通过诱导细胞周期阻滞从而导致细胞衰老,而BCL-2选择性抑制剂APG-2575不仅诱导细胞周期阻滞,而且还可以触发细胞凋亡。BCL-2和CDK4/6抑制剂联合用药能进一步协同诱导细胞周期阻滞,最重要的是有效地清除了由Palbociclib诱导产生的衰老细胞,诱导癌细胞凋亡。
黑色素瘤
公司:百济神州
产品:Sitravatinib联合百泽安®
适应症:黑色素瘤
阶段:1b期临床试验数据
百济神州抗 PD-1 抗体百泽安®联合与Mirati Therapeutics, Inc.合作开发的在研选择性激酶抑制剂sitravatinib在针对黑色素瘤的1b期临床试验中展现了初步抗肿瘤活性。
在5.5个月的中位随访时间内,25例先前PD-1/PD-L1 疗法难治性或耐药性且未接受过其他免疫疗法的的不可切除或转移性黑色素瘤患者,经确认的ORR为24%,其中6例患者达到了PR,DCR为88%。所有患者均经历了至少一起任一级别的治疗期间出现的不良事件(TEAE),患者患者总体耐受良好。
卵巢癌
公司:百济神州
产品:Sitravatinib联合百泽安®
适应症:晚期铂类耐药卵巢癌(PROC)
阶段:1b期临床试验数据
截至数据截点2020年10月13日,共有 60 例先前未接受过抗 PD-1/PD-L1 治疗的复发性PROC患者入组了1b期试验,其中13例(22%)仍在接受研究治疗。这些患者先前接受过的中位治疗线数为4。
在中位随访时间为6个月时,被纳入有效性评估的53例患者中经确认的ORR为26%,其中14例患者达到了PR,DCR为77%,中位DoR为4.7个月,中位PFS和OS分别为 4.1个月和12.9 个月。所有患者均经历了至少一起任一级别的TEAE,70%的患者经历了至少1起严重TEAE。
公司:亚盛医药
产品:APG-2449
适应症:卵巢癌
阶段:临床前试验数据
在卵巢癌治疗中,局灶粘附激酶(FAK)是一个有前景的作用靶点,高达70%的卵巢上皮癌患者存在FAK过表达、扩增或激活,该标志物也与卵巢癌患者肿瘤分期、肿瘤转移和缩短总生存期显著相关。
临床前数据显示,FAK/ALK/ROS1多酶抑制剂APG-2449与标准化疗药物联合使用,能够通过抑制FAK的功能从而使卵巢癌对化疗药物再次敏感,药物的联合通过减少肿瘤干细胞的数量并显示协同抗肿瘤活性。目前APG-2449已进入临床1期阶段。
神经内分泌肿瘤
公司:亚盛医药
产品:APG-1252
适应症:神经内分泌肿瘤
阶段:临床前试验数据
在神经内分泌肿瘤的治疗方面,目前的靶向疗法如VEGFR抑制剂舒尼替尼和mTOR抑制剂依维莫司虽然可以延长G1和G2级神经内分泌肿瘤(NET) 患者的无进展生存(PFS),但客观应答率仍较低。
临床前研究数据表明,BCL-xL在NEN中起着重要作用。细胞对BCL-2/BCL-xL抑制剂APG-1252-M1的敏感性与BCL-xL复合物的本底水平相关。在NEN患者样本中,MCL-1也出现高表达,这意味着它可能对APG-1252的敏感性产生负调控作用。BCL-xL和MCL-1蛋白的同时高表达提示针对这两种蛋白的联合治疗可能对NEN更有效。
血液恶性肿瘤
公司:德琪医药
产品:ATG-010联合ATG-010
适应症:三重打击弥漫性大B细胞淋巴瘤
阶段:临床前试验数据
单药口服XPO1抑制剂ATG-010和mTORC1 / 2双靶点抑制剂ATG-010是德琪医药的两款核心产品。此次该公司带来了这两款“明星”产品联用治疗三重打击弥漫性大B细胞淋巴瘤(DLBCL)协同效果的临床前数据。
试验表明,ATG-010联合ATG-008在体内体外均表现出抗肿瘤和协同作用,在三重打击弥漫性大B细胞淋巴瘤细胞株中也具有强大的协同性。同时,在DLBCL异种肿瘤移植物中模型中,ATG-010和ATG-008的联合治疗同时增强了对肿瘤生长的抑制效果,显示出协同的抗肿瘤作用。
公司:亚盛医药
产品:HQP1351、APG-2575
适应症:急性髓系白血病
阶段:临床前试验数据
在2021AACR期间,亚盛医药带来了两项有关FLT3-ITD突变的急性髓系白血病(AML)的临床前试验数据,以及一项HQP1351与变构抑制剂ABL001联合使用治疗BCR-ABL复合突变引起的耐药的临床前数据。
FMS样酪氨酸激酶3抑制剂HQP1351与Bcl-2选择性抑制剂APG-2575联合用药在AML患者治疗中具有协同作用,新型口服Bcl-2选择性抑制剂APG-2575和高三尖杉酯碱(HHT)在临床前AML/MDS肿瘤模型中的协同抗肿瘤作用,而HQP1351与ABL001联用则有助于克服酪氨酸激酶抑制剂治疗后的继发性复合突变。
这些结果为HQP1351和APG-2575联合用药、APG-2575与HHT联合用药、HQP1351与ABL001联用的临床开发提供了依据。
公司:亘喜生物
产品:同种异体CAR-T疗法GC027
适应症:复发或难治急性T淋巴细胞白血病
阶段:1期临床试验数据
2021AACR期间,亘喜生物以电子海报形式公布了其基于TruUCAR平台开发的通用型同种异体候选产品GC027治疗复发或难治急性T淋巴细胞白血病(r/r T-ALL)成人患者的1期临床试验数据。
GC027是一款首次用于人体试验、靶向CD7的通用型同种异体CAR-T疗法。6位接受了单次输注的参与者均完全缓解率达100%,5人(83%)达到最小残留病灶阴性的完全缓解(MRD-CR)。在接受治疗6个月后,这5位参与者中的3人(60%)仍然保持MRD-CR状态。1位参与者在接受治疗的16.8个月时仍然保持MRD-CR状态,1人保持了9个月的MRD-CR状态,1名原发难治性(对VDP化疗方案无响应)的患者保持MRD-CR状态达7个月。
此外,另1位参与者最初表现为高肿瘤负荷以及广泛性髓外病变,在接受了TruUCAR GC027疗法后,经PET-CT扫描确认,所有髓外病灶均已清除,且患者在第28天达到MRD-CR状态。治疗期间,未观察到神经毒性事件(ICANS)或急性移植物抗宿主病(aGvHD)的发生。
其他报告
公司:先声药业
产品:II型肿瘤坏死因子受体(TNFR2 )项目
适应症:多类肿瘤模型
阶段:暂无
随着CTLA-4和PD-(L)1单抗的相应获批上市,免疫疗法已经成为肿瘤治疗的重要手段,但是这类疗法响应率往往低于20%。此次AACR会议上,先声药业带来了三项重要的论文摘要,对外展示了该公司在II型肿瘤坏死因子受体(TNFR2 )这一肿瘤免疫治疗领域的创新布局。
TNFR2是TNF受体超家族成员,在多类肿瘤中的选择性表达为表面癌基因,具有促进肿瘤细胞增殖的功能。先声药业使用小鼠TNFR2抗体(suAb)单药或与mpd -1抗体(CT26)联合治疗后,在不同肿瘤模型中都观察到肿瘤生长的显著抑制,体内研究中也发现TNFR2抗体可以减少肿瘤内Treg的数量/百分比,改善CD8 / Treg比率。目前先声药业的TNFR2项目处于临床前阶段的深度开发中。
公司:亚盛医药
产品:APG-1387联合CTB-006
适应症:实体瘤
阶段:临床前数据
TNF相关凋亡诱导配体(TRAIL)受体(DR4或DR5)激动剂可以选择性的诱导癌细胞凋亡,是潜在的癌症治疗药物。然而,其在临床研究中,其效果受到原发性或获得性耐药的限制。
在临床前模型中,亚盛医药评估IAP小分子拮抗剂APG-1387联合DR-5抗体激动剂CTB-006在实体瘤中的药效。数据显示,二者具有协同抗肿瘤活性,联合组的所有小鼠肿瘤均出现CR、PR和疾病稳定(SD),这为APG-1387联合CTB-006在实体瘤治疗的临床开发上提供了科学依据。目前,两种药物均处于实体瘤临床I/II期开发阶段。
除本土制药企业外,国际制药企业同样在本次AACR上带来了癌症治疗的最新数据,比如礼来公布了其新一代KRAS G12C抑制剂的临床前数据,显示该产品的抗癌活性较AMG 510提高10倍,百时美施贵宝公布了其明星产品抗PD-1抗体欧狄沃联合疗法3期临床研究CheckMate -648的阳性结果。
参考资料:
[1]各公司官网及相关媒体报道







