当地时间4月27日,世界上较大规模的癌症研究会议之一美国癌症研究协会(AACR)年会开幕。由于新冠疫情的影响,今年采用的是线上会议的仪式,而且分为两部分进行(AACR Virtual Annual Meeting I和AACR Virtual Annual Meeting II)。

AACR-I于当地时间4月27-28日举行,重点聚焦临床和转化医学的研究。具体包括30多场口头报告和专家讨论,报告一系列癌症临床试验的结果,讨论临床试验背后的科学观点;另外,还会有一系列关于癌症基础和转化医学科学的专题讨论会,以及三场“新药在望"(New Drugs on the Horizon)的小型专题讨论会,其中内容将包括首次公布最近进入 I 期临床试验的许多创新小分子和生物制剂研究进展。AACR-II则于当地时间6月22-24日线上举办。综合AACR年会公开日程以及企业官网信息,恒瑞医药、世和基因、豪森药业等均有亮眼表现。
恒瑞医药

Camrelizumab plus apatinib in extensive-stage small-cell lung cancer(PASSION):Amulticencer,two-stage,phase 2 trial
卡瑞利珠单抗和阿帕替尼分别为恒瑞医药研发的PD1单抗和口服抗血管多靶点TKI,双药组合在多个癌种都在火热进行研究,初步数据非常亮眼,并且做到了无化疗!这项由王洁教授团队进行的研究纳入了2018年4月-2019年3月期间的59例既往铂类耐药的广泛期SCLC患者,随机分为阿帕替尼 375mg每日服用组,5天连服后停两天组和连服7天停7天组。卡瑞利珠单抗均为200mg/2周。
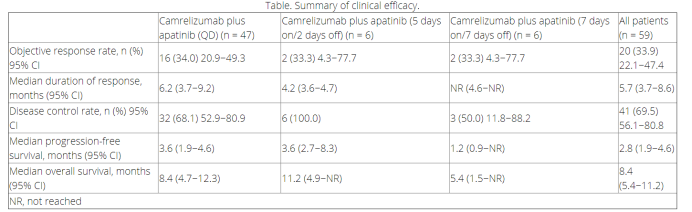
结果显示,在阿帕替尼每日连服组中,ORR(客观缓解率)达到了34%,中位PFS(无进展生存期)为3.6个月,中位OS(总生存期)为8.4个月。无论患者既往对化疗敏感(≥90天后复发)或抵抗(<90天内复发),ORR都不错(37.5% vs 32.3%),中位PFS为3.6 vs 2.7个月,中位OS为9.6 vs 8个月。治疗相关3级及以上AE发生率为72.9%。总体不良反应可管理。
对于化疗后进展的SCLC患者,预后并不佳。恒瑞PD1+阿帕替尼在后线治疗仍可以达到34%的ORR级8.4个月的OS,已经是超越了现有所有标准治疗的疗效。并且,这两种药物目前国内都已经上市,药物可及,名副其实的给SCLC患者提供了高效的无化疗方案。
世和基因

本届AACR年会,世和基因共中稿10篇壁报,壁报内容将分为3个篇章,与AACR年会同期发布。3个篇章分别为超大样本分析看肺癌“罕见”突变对“常见”治疗方式的响应与提示篇章;NGS检测新思路开启MSI、BRCA检测新体验篇章;分子层面探秘肿瘤的演化过程。
MET、ROS1、FGFR等罕见驱动基因突变发生率较低,因此针对携带罕见突变的患者群体进行研究较为困难,许多罕见突变对靶向药物的响应和耐药机制目前尚不清楚。通过基于NGS技术的大Panel检测,进行更全面的基因突变图谱研究和药物疗效监测,有助于探索更多的罕见靶点和耐药机制,优化精准治疗方案,为患者带来更多治疗机会。
Genomic and clinical characteristics of MET exon14 alterations in 26,391 Chinese cancer patients
MET基因14外显子(METex14)及其两侧内含子区域的基因变异,可引起MET激活,进而导致肿瘤发生。研究表明,携带METex14突变的患者通常能够从克唑替尼等药物中获益。
本研究回顾性分析了6,391名中国肿瘤患者METex14突变情况及克唑替尼治疗的疗效。整体人群METex14突变发生率约为0.7%(184/6391),其中肺癌患者METex14突变发生率约为1.1%(175/1591),低于西方人群的发生率(3-7%)。本研究检测到78种METex14突变,主要突变类型为剪切位点的碱基替换(42%)和13内含子的插入/缺失突变(28%)。非14外显子MET突变发生率为11%,MET扩增发生率为4%。接受克唑替尼治疗的14例患者,mPFS为7个月,最长PFS为17个月。克唑替尼耐药的患者中,2例患者继发MET突变,1例患者继发BRAF p.K601E突变,提示可能是克唑替尼耐药新机制。
MET基因14外显子突变在中西方人群中发生率存在差异,其主要突变类型为剪切位点的碱基替换和13内含子的插入/缺失突变,继发MET突变和BRAF p.K601E突变可能是克唑替尼耐药新机制。
Molecular and clinicopathological characteristics of Chinese non-small cell lung cancers with ROS1 gene fusions identified by next-generation sequencing
ROS1基因融合发生率为1-2%,目前已经确定的ROS1融合的伴侣基因约20种。克唑替尼等药物对携带ROS1融合的NSCLC患者有较好的疗效。
本研究对17,158例中国NSCLC患者肿瘤标本和/或cfDNA进行NGS分析,同时评估了其中37例接受克唑替尼治疗的患者的PFS。ROS1阳性NSCLC患者约为1.7%(288/17158),其中ROS1融合的发生率为89.6%(258/288),最常见的伴侣基因是CD74(40%),其他常见伴侣基因包括:EZR、SDC4、SLC34A2、TMP3等。ROS1融合的主要断裂点发生在31-34内含子区(约90%),且没有明显的热点。另外,5.4%的ROS1融合发生在基因间隔区域(IGR),主要位于ROS1的同一染色体上,融合产物未知。37例接受克唑替尼治疗的患者中,ROS1融合发生在31-34内含子区的患者mPFS无显著差异,而非CD74-ROS1融合的患者(n=23)比CD74-ROS1融合的患者倾向于有更长的mPFS。11例克唑替尼耐药的患者检测到ROS1 G2032R和S1986F耐药突变。此外,三分之二携带不明特征融合伴侣(IGR-ROS1)的患者可以从克唑替尼治疗中持久受益。
超万例样本NGS检测显示中国NSCLC患者ROS1突变发生率为1.7%,主要突变类型为融合突变,发生率为89.6%。ROS1融合常见伴侣基因包括CD74、EZR、SDC4和SLC34A2等。非CD74-ROS1融合的患者比CD74-ROS1融合的患者对克唑替尼治疗可能获益更多。
Landscape of FGFR activating aberrations in Chinese non-small cell lung cancer
成纤维细胞生长因子受体(FGFR)信号功能异常在NSCLC中,尤其是肺鳞癌中较为常见。
本研究采用NGS检测,回顾性分析了10,966例NSCLC患者的肿瘤标本和/或cfDNA的突变特征。约1.9%(210/10,966)的NSCLC患者检测到FGFR基因突变,突变类型包括点突变、融合和扩增,并且FGFR致癌突变中的点突变、融合和扩增互相排斥。肺鳞癌中FGFR突变发生率为6.8%(65/954),显著高于肺腺癌(1.3%)。约0.11%的患者检测到了保留完整激酶结构域的FGFR融合,包括9例FGFR3-TACC3融合、1例FGFR2-INA融合、1例FGFR4-RAPGEFL1融合和1例FGFR1与SLC20A2 5'-非翻译区的融合(可能导致FGFR1过表达)。值得注意的是,6例患者同时检测到EGFR突变或扩增,其中4例接受过EGFR-TKIs治疗,且在NGS检测前均发生疾病进展,表明FGFR融合可能是EGFR-TKI继发耐药机制之一。此外,24例患者检测到FGFR扩增突变,且FGFR1扩增发生率最高。超万例样本NGS检测,回顾性分析了中国NSCLC患者FGFR突变的发生率和突变特征。结合临床治疗史发现,4例接受过EGFR-TKIs治疗的患者在NGS检测前均发生疾病进展,表明FGFR融合可能是EGFR-TKI继发耐药机制之一。
豪森药业


在4月27日举行的“II期临床试验专场(Phase II Clinical Trials)”上,豪森药业公布了自主研发1类创新药阿美乐®(甲磺酸阿美替尼片)最新临床研究结果。由上海交通大学附属胸科医院陆舜教授口头报告了阿美乐在EGFR T790M 突变阳性的局部晚期或转移性非小细胞肺癌(NSCLC)患者Ⅱ期临床最新研究结果。
阿美替尼II期研究(APOLLO)共入组244例经一、二代EGFR-TKI治疗后出现疾病进展,并且经检验确认存在EGFR T790M突变阳性的NSCLC患者。基线数据显示,本研究共纳入37.3%(91例)的无症状脑转移患者,其中23例脑转移患者经研究者判断基线有颅内靶病灶,组成CNS分析组。
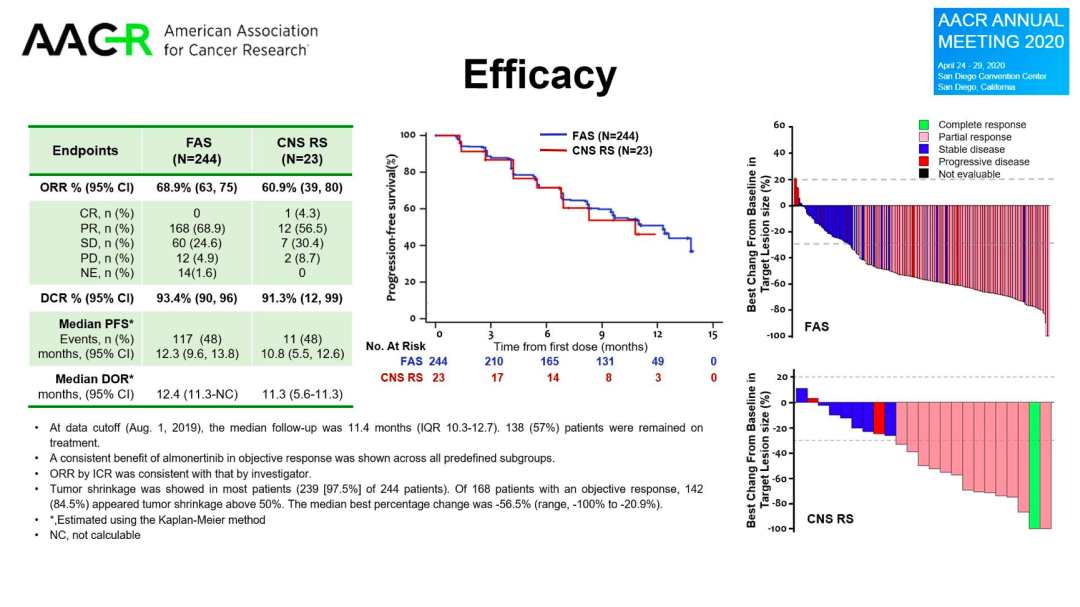
数据显示,中位随访时间11.4个月时,阿美替尼二线治疗经治EGFR T790M突变阳性NSCLC患者疗效确切。经独立评审委员会评估,阿美替尼在脑转移患者中,疗效与总人群相仿。随着随访时间的延长,阿美替尼的长期安全性得到了进一步的验证,其不良事件发生率低,无间质性肺炎的发生,安全性良好。
亘喜生物

此次AACR年会上,亘喜生物报告其通用型TruUCAR™ GC027产品的一项1期临床试验数据。该首次人体(first-in-human)试验旨在验证其治疗复发或难治(R/R)急性T淋巴细胞白血病(T-ALL)的可行性。
Safety and efficacy clinical study of TruUCART™ GC027: the first-in-human, universal CAR-T therapy for relapsed/refractory T-cell acute lymphoblastic leukemiaGC027是以TruUCAR™技术为基础的产品,来源于无需HLA匹配的健康供者细胞,经过体外基因修饰表达嵌合抗原受体(CAR),同时增强了细胞的性能,从而可特异高效地消除T肿瘤靶细胞。TruUCAR TM技术无需通过联合抗CD52药物来抑制肿瘤细胞,诱导患者体内产生长期免疫抑制来促使即用型CAR-T细胞在体内扩增和杀伤肿瘤细胞。GC027经过亘喜特有的CRISPR基因编辑策略的改造,可以达到避免移植物抗宿主病(GvHD)、减轻患者免疫系统引起的排斥反应、并在体内有效扩增,达到清除肿瘤靶细胞的目的。







