近年来,抗体药物、融合蛋白药物在肿瘤、自身免疫病等领域开始发挥越来越大的作用,生物药市场也保持着高速增长的趋势,但是,这些生物制品多是源于微生物、细胞、动物或人源组织和体液等生物体,这些起始原材料或辅料潜在的病毒污染毫无疑问将对产品安全性产生关键影响。以最常见的CHO细胞蛋白表达系统为例,CHO细胞常表达内源性逆转录病毒样颗粒,在细胞上清中通常可检测到 10 3 ~10 9 /mL 逆转录病毒样颗粒而且CHO细胞在培养过程中有可能发生外源性病毒污染,因此,各国药监机构都要求临床试验前和生产阶段前的申报材料中,必须经过病毒清除/灭活验证。

1. 不同类生物制品的病毒安全性控制要点
人血液制品:包含生物制品病毒安全性控制的所有要素,重点应考虑人血浆来源的病毒风险控制和生产工艺过程的病毒清除能力,必要时应实施对上市产品病毒安全性的追溯。
动物体液/组织:最大风险来源于起始原材料。重点应考虑起始原材料的动物病毒特别是人畜共患病毒的风险控制,以及生产工艺过程的病毒清除能力,必要时应对产品进行病毒污染的检测。
疫苗:以对起始原材料、原材料和辅料的病毒污染来源控制为主,主要包括病毒污染的检测和筛查。
重组治疗性生物制品:重点考虑对工程细胞基质、工程菌、原材料和辅料的病毒污染来源控制。采用动物细胞表达的重组治疗性生物制品还应重点考虑生产工艺过程的病毒清除能力。
基因治疗产品:重点考虑对细胞基质、菌毒种、原材料和辅料的病毒污染来源控制。
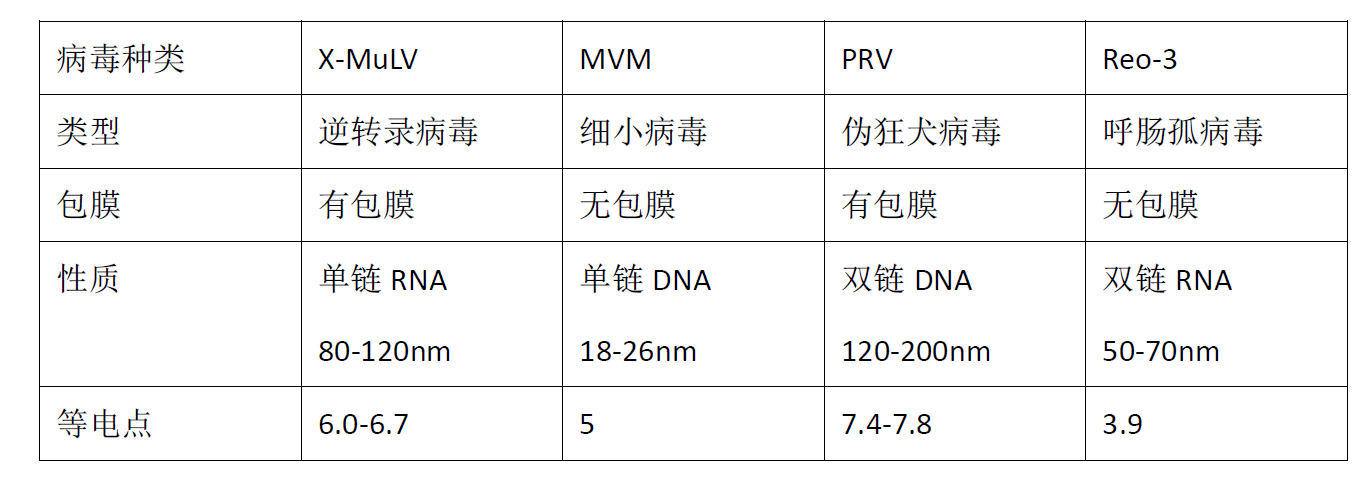
2. 指示病毒
指示病毒用来衡量病毒清除/灭活的效果,美国、欧盟等药监机构官员及病毒学领域的科学家建议,在病毒清除验证过程中采用的病毒包含以下四种特性:“单链和双链的RNA及DNA、脂包膜和非脂包膜、强和弱抵抗力、大和小颗粒等”。
常用的四种指示病毒如下表:
3. 国内外申报差异:
3.1.指示病毒的差异
3.2.工艺上的差异
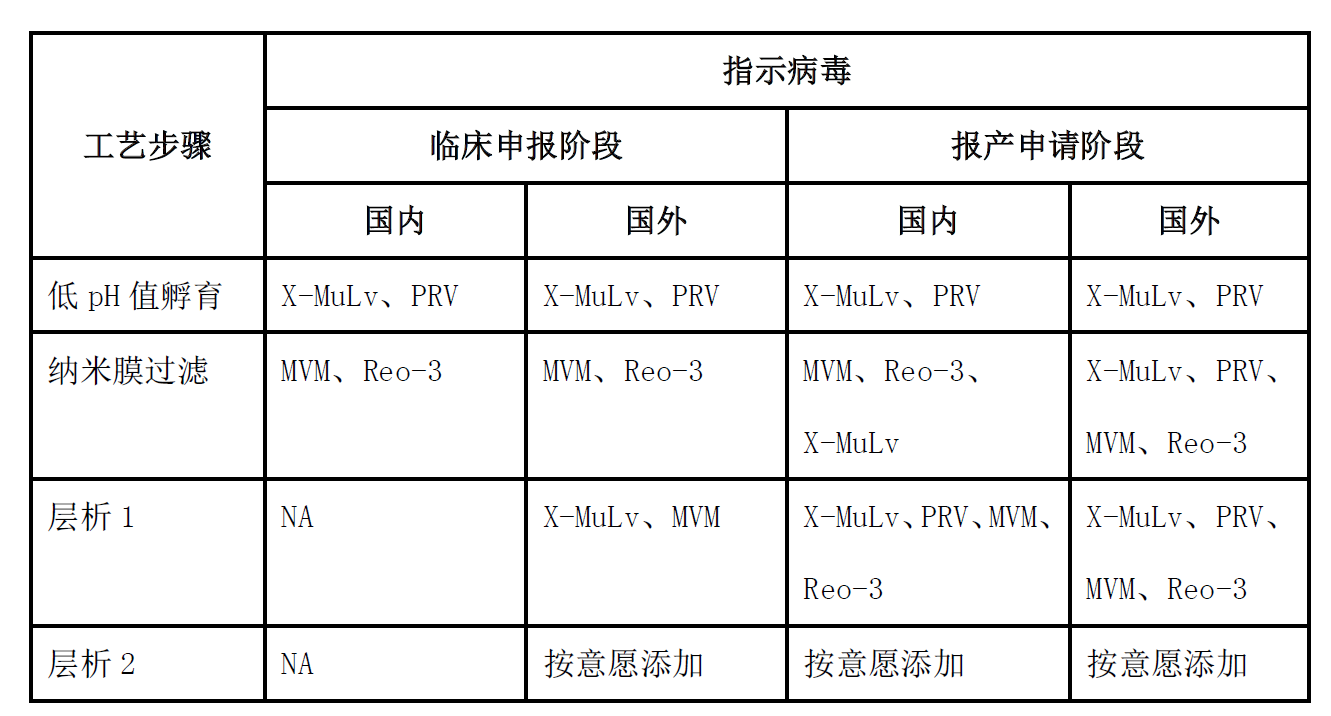
在工艺重复性方面,国内的指导原则虽然没有硬性的规定,但通常需要做三个批次。在国外的指导原则中,明确指出至少分别做两次独立的研究来证实清除的可重复性,因此一般是一批样品重复两次。在工艺选择上,国内IND申报时,一般选择低pH和膜过滤这两个工艺。国外进行申报时,除了选择低pH和膜过滤这两个工艺,还需进行层析工艺。
4. 新药典对病毒安全的政策
2019年6月27日,国家药典委员会发布了《生物制品病毒安全性控制公示稿》,这个药品标准草案的公示无疑把生物制品的病毒清除/灭活的标准化提上日程,从而引起了整个生物制品圈对于病毒安全保证的重视。近年来随着单克隆抗体和重组蛋白类等生物制品的研发越来越火热,国内外药品申报对于病毒清除验证的研究也越来越重视,生物制药企业对于病毒清除/灭活的需求越来越迫切。但是各技术服务机构由于人才、经验、技术等实力相差悬殊,找到可靠的机构并不容易。

义翘神州凭借超过500次病毒灭活/清除验证研究经验和100%的成功率(已有6个产品全部申报成功),在国内病毒清除市场上占有重要份额。11月1日14:00来自义翘神州的徐明明老师专门针对病毒安全性控制,在易科学公开课平台做一次《病毒去除/灭活的方法及工艺选择》专题讲座,本次讲座就病毒灭活、病毒去除方法以及国内外申报差异等方面内容进行阐述,帮助大家更好的选择病毒清除验证研究的工艺。本次课程的课件、答疑等相关干货也将在“北京义翘神州”公众号发布,敬请关注。
【直播题目:病毒去除/灭活的方法及工艺的选择】
报名二维码:








