本文转载自“DIA订阅号”。

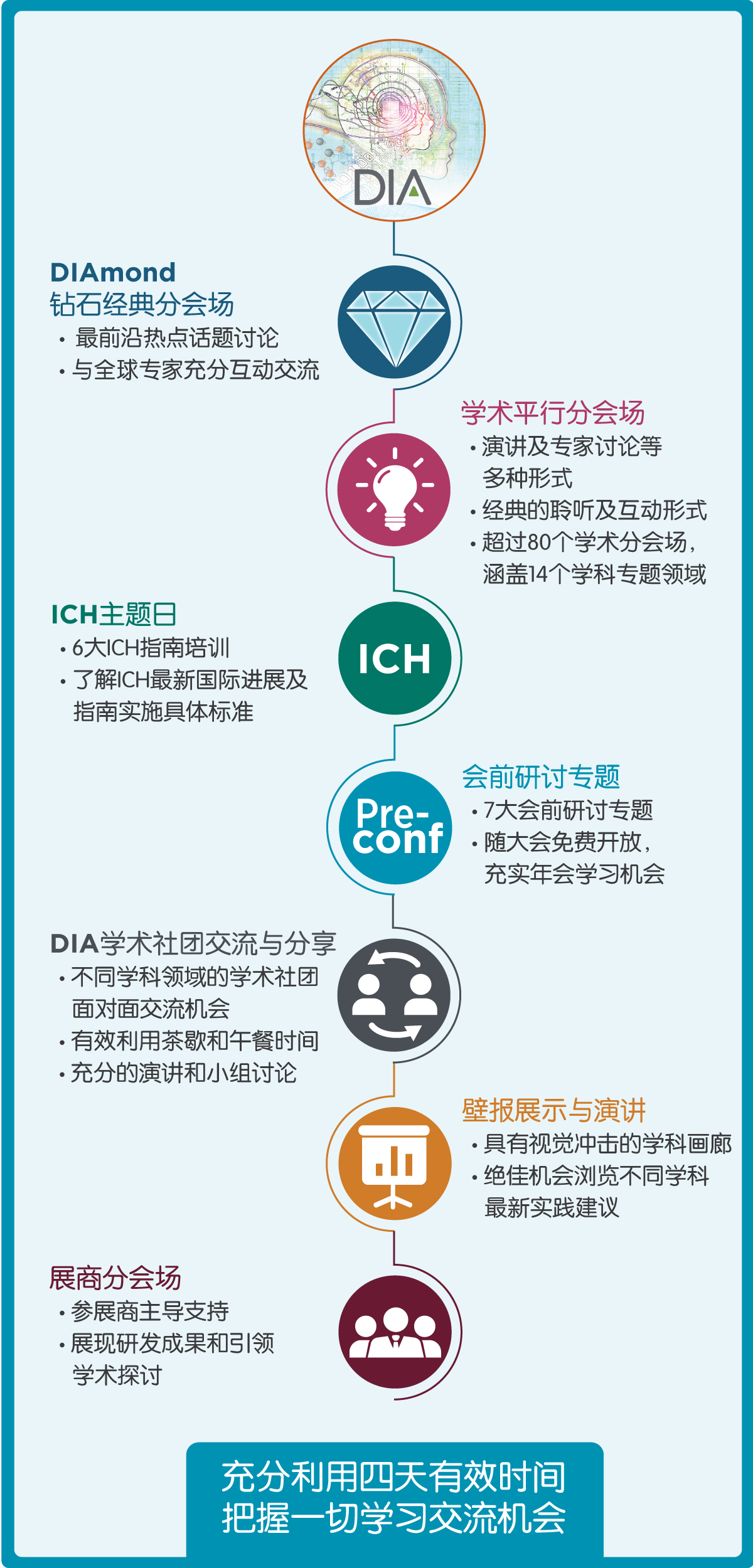
在2019年5月20 - 23日即将到来的2019中国国际药物信息大会暨第十一届DIA中国年会中,将以药品监管科学为核心,着力关注中国的药品安全和质量,回归临床研发以患者为中心的初心。计划围绕ICH指南的实施与新进展、监管科学、临床运营和质量合规、药物警戒及风险管理、数据标准等领域设立14个专题80余个分会场,助力夯实新药研发基础,促进高质量的新药开发,切实满足患者的需求。
大会还特别增设半天的会前研讨专题,7个会前研讨专题将覆盖真实世界证据对药品注册的支持、数据管理、临床质量、生物类似药及非临床方案设计等内容为大会主题分会场预热,丰富您的参会体验。
大会涵盖形式多样的学习模式,让您充分聆听、探讨、互动并思考。
在线注册
早期注册优惠截止日: 3月31日
本次会议将不开放现场注册
在线注册请长按识别二维码

初步日程下载,请长按识别二维码

2019中国国际药物信息大会
暨DIA中国年会
2019年5月20-23日 | 北京国际会议中心
邀您免费参与 !!!
七大会前研讨专题, 涵盖临床质量管理,数据合规,法规科学,非临床开发,生物类似药等不同领域
2019年5月21日 | 8:30 – 12:30
中心影像规范管理与实施
主讲人

贺文 博士
主任医师, 北京友谊医院放射科主任, 首都医科大学临床诊断学教授,博士生导师

王仁贵 博士
首都医科大学附属北京世纪坛医院放射科主任
非临床法规要求及开发计划 (英文专场, 席位有限)
主讲人

Beatriz Silva LIMA 博士
葡萄牙里斯本大学药理学教授,NDA顾问委员会成员
组委会联席主席

胡蓓 医学博士
北京协和医院临床药理中心临床药理学教授
生物类似药:从开发,法规到商业考量 (英文专场, 席位有限)
主讲人

Hoss A. DOWLAT 博士
德国PharmaBio Consulting公司副总裁
组委会联席主席

张海洲 医学博士
博际生物医药科技(杭州)有限公司首席执行官
更多精彩内容
大数据和真实数据如何用于支持注册
组委会联席主席
苏岭 博士
沈阳药科大学教授,礼来亚洲基金风险合伙人
吕玉真
罗氏药品临床研发亚太区注册事务负责人
质量管理体系:从概念到实践 (席位有限)
组委会主席
周丽萍
默沙东研发(中国)有限公司亚太区质量保证总监
Auditing eSource (英文专场, 席位有限)
组委会联席主席
Ellyne SETIAWAN
勃林格殷格翰质量负责人
Matt JONES
Digital Qaulity Associates公司董事总经理
eCTD申报技术要点介绍
组委会主席
刘川 博士
北京科林利康医学研究有限公司董事长/首席科学官
关于会议住宿
请长按识别下方二维码
了解详情

联系 DIA
会议咨询:DIA 中国
Tel.: +86. 10. 5704 2659
Email: China@DIAglobal.org
会议内容:宁尔宁
Tel.: +86. 10. 5704 2655
Email: erning.ning@DIAglobal.org
Posters:Lily WANG
Tel.: +86 21. 6042 9833
Email: lily.wang@DIAglobal.org
展览及广告机会
2019DIA中国年会为公司提供多种展示机会, 包括:展览、会议支持、会刊广告等
销售工作由中国食品药品国际交流中心负责。预定请联系:
郑鹏 先生
Email: zhengpeng@ccfdie.org
电话: +86 10 8221 2866 6007
成建英 女士
Email: chengjy@ccfdie.org
电话: +86 10 8221 2866 6008
传真: +86 10 8221 2857







