为了进一步加强医疗器械分类管理,发挥专家在医疗器械分类工作中的作用,2015年国家食品药品监督总局(CFDA)发布了《食品药品监管总局关于成立医疗器械分类技术委员会的通知》,依据《医疗器械监督管理条例》《医疗器械分类规则》有关规定,决定成立医疗器械分类技术委员会,作为医疗器械分类及相关工作的技术支撑。2017年3月7日,CFDA官网公示了医疗器械分类技术委员会专业委员候选人名单,共有16个专业组285名委员入选,公示时间截止至3月16日。
推进医疗器械管理分类改革是《“十三五”国家药品安全规划》的主要任务之一。“十三五”指出,加快医疗器械分类管理改革,组建16个分类技术专业组,优化调整分类目录框架及结构,发布新版《医疗器械分类目录》,按专业领域设置研究制定22个命名术语指南,建立医疗器械分类、命名及编码数据库。
建立行政主导、技术权威的医疗器械分类技术委员会,为医疗器械分类管理提供技术支撑,保障医疗器械分类的科学性、公正性和权威性,提高分类决策管理水平,夯实医疗器械监管基础,具有十分重要意义。
成立医疗器械分类技术委员会,将目前总局标准管理中心直接组织专家研究分类界定技术工作的模式逐步过渡到分类技术委员会及其各专业组研究分类界定,是建立健全医疗器械分类管理工作机制的重要举措。在此基础上,总局将依据分类技术委员会的技术支持,改革现行医疗器械分类目录框架,合理设计分类目录的整体架构和层级结构,建立医疗器械产品风险变化的评估机制,及时对医疗器械的风险进行分析评价,合理划分部分产品的管理类别,动态调整医疗器械分类目录。
专业组委员的职责与义务
食药监办械管函〔2015〕838号文件规定专业组委员的职责与义务为:
(一)收集医疗器械技术发展相关信息,跟踪国内外技术发展和监管政策发展动态,对医疗器械监管建言献策;
(二)参与医疗器械产品风险评估、相应技术领域医疗器械产品分类界定分类目录维护等相关工作;
(三)承担分配的各项工作任务并按时出席各种会议、活动;
(四)执行委员会的各项决议;
(五)保守工作秘密,当相关会议、活动或文件与本人利益相关时,应当主动提出回避;
(六)诚实守信,廉洁公正,不得利用委员身份获取不正当利益。
根据专业组委员的职责与义务,这285名委员将直接参与本组相关医疗器械产品的风险评估、分类界定、分类目录维护等工作。也就是说所生产的产品属于一类、二类、还是三类医疗器械?是否需要注册?要不要拿经营许可证?或者只需备案即可?……这类问题今后将先由这些285名委员们具体研究界定。此外即将发布的新版《医疗器械分类目录》,他们也将起到关键作用。
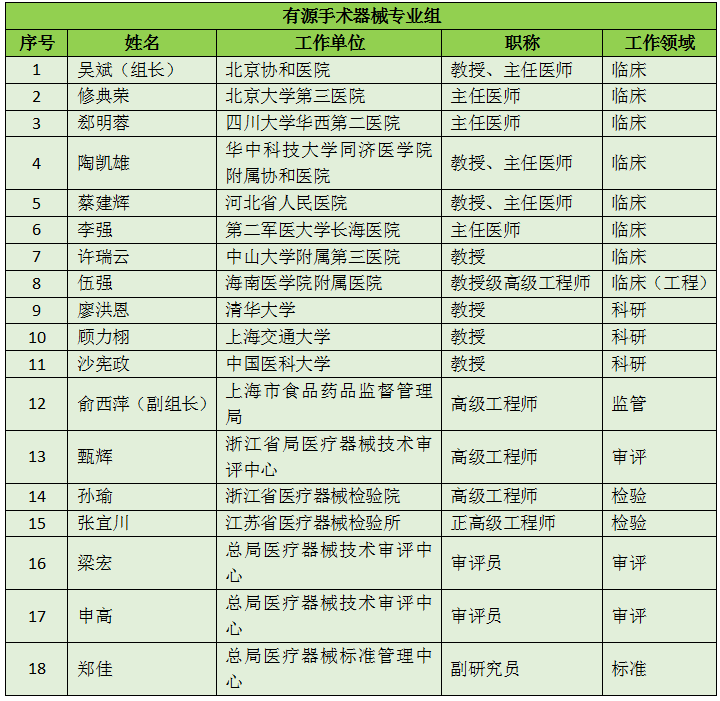
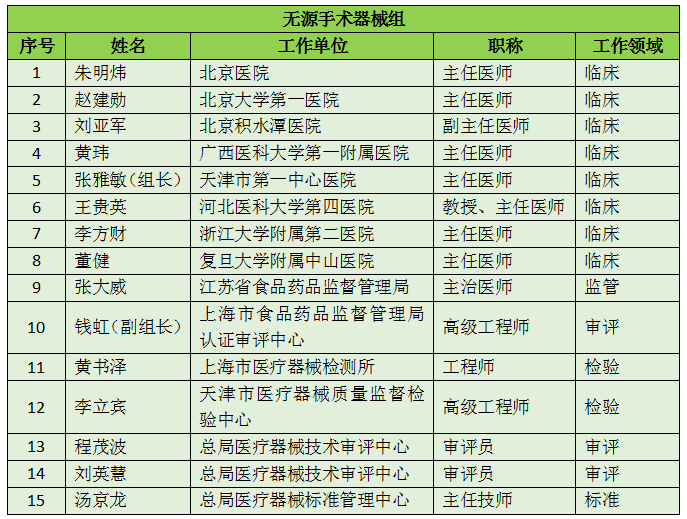
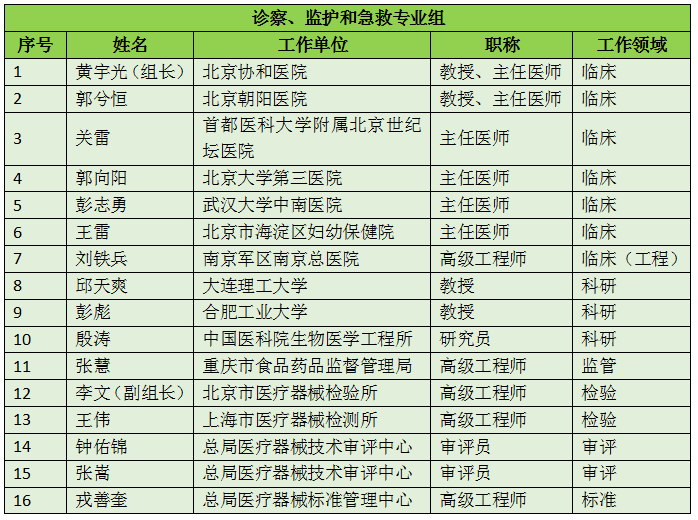
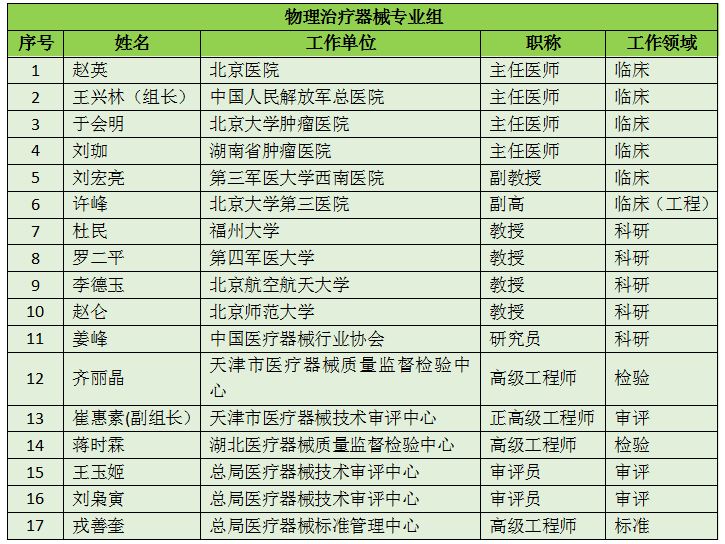
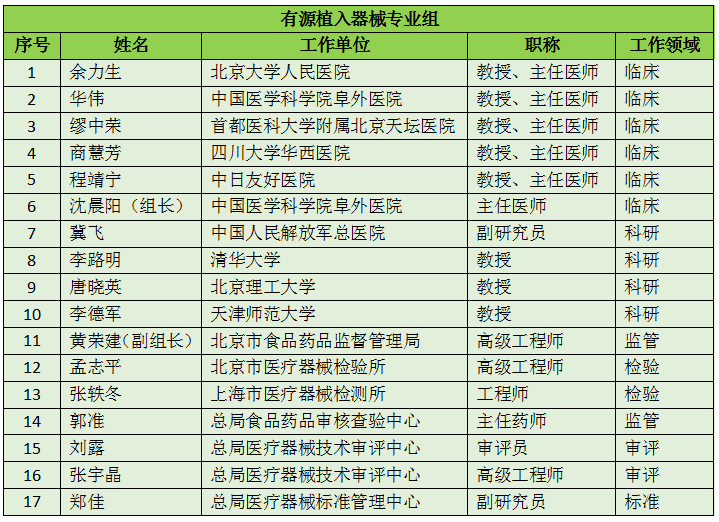
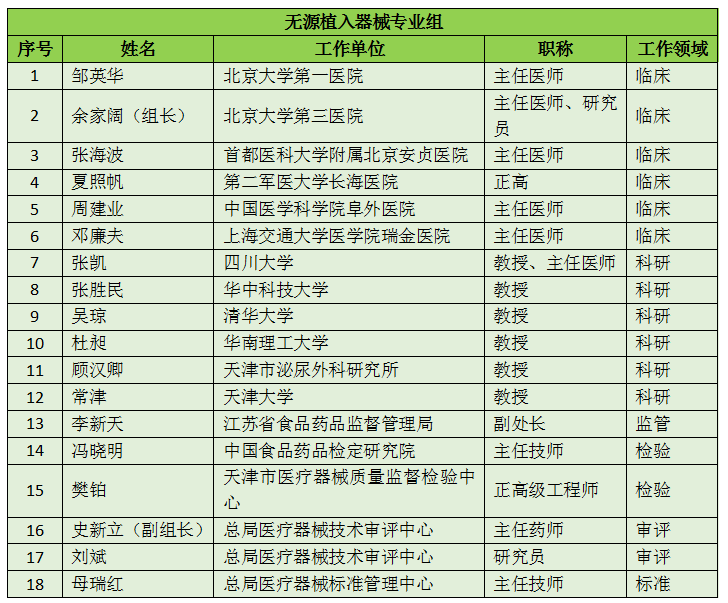
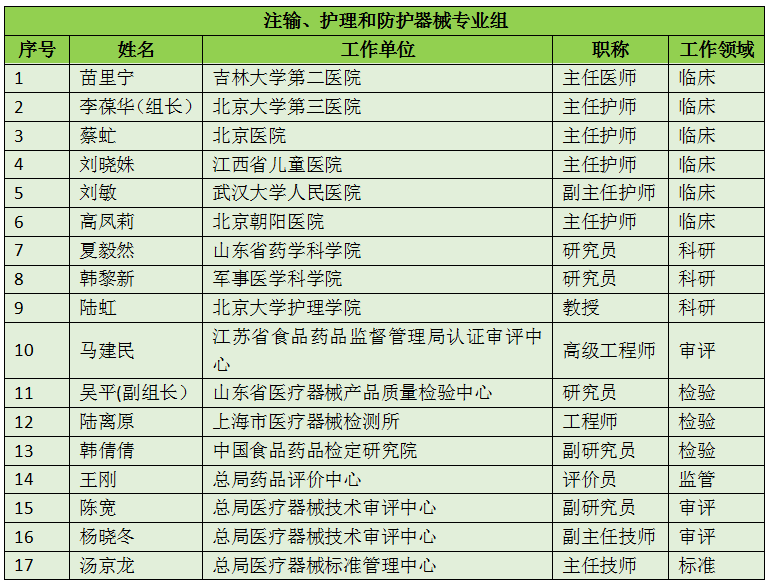
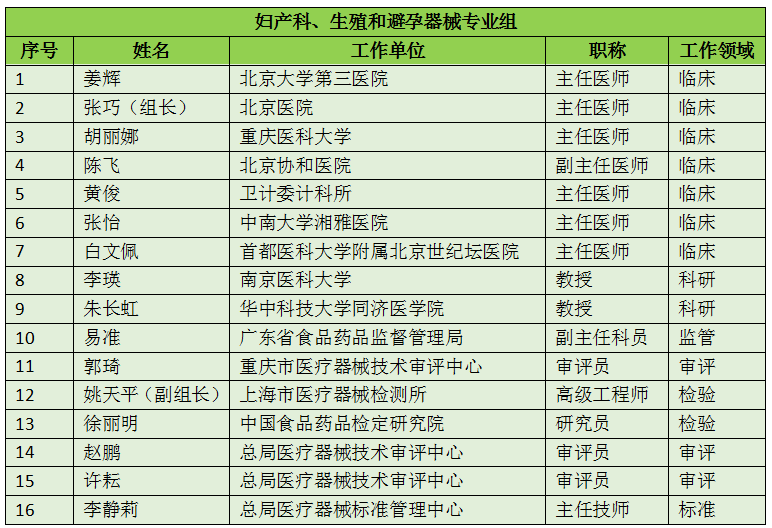
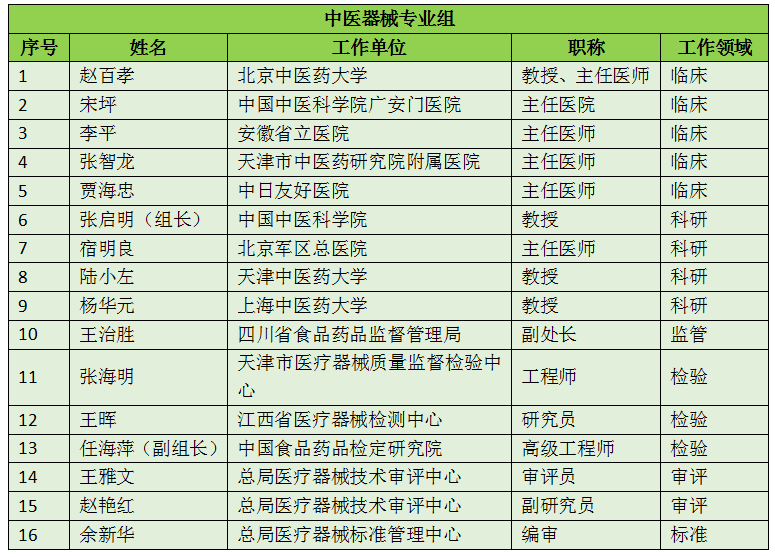
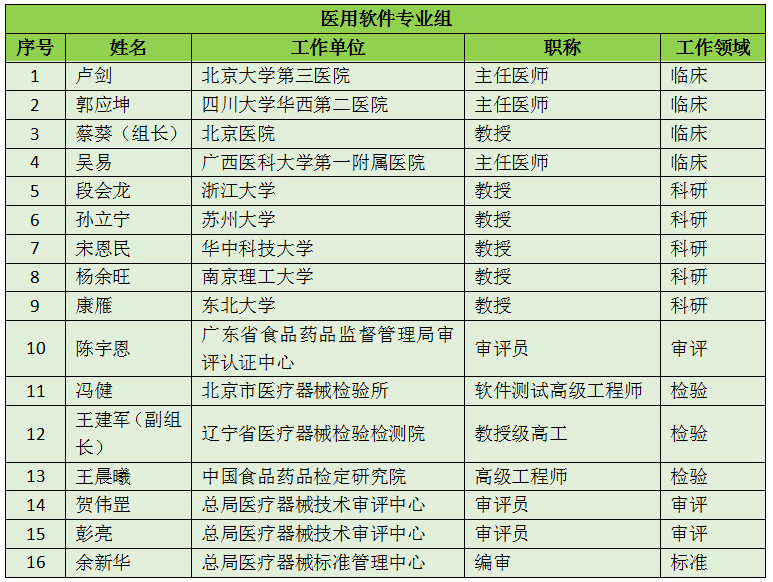
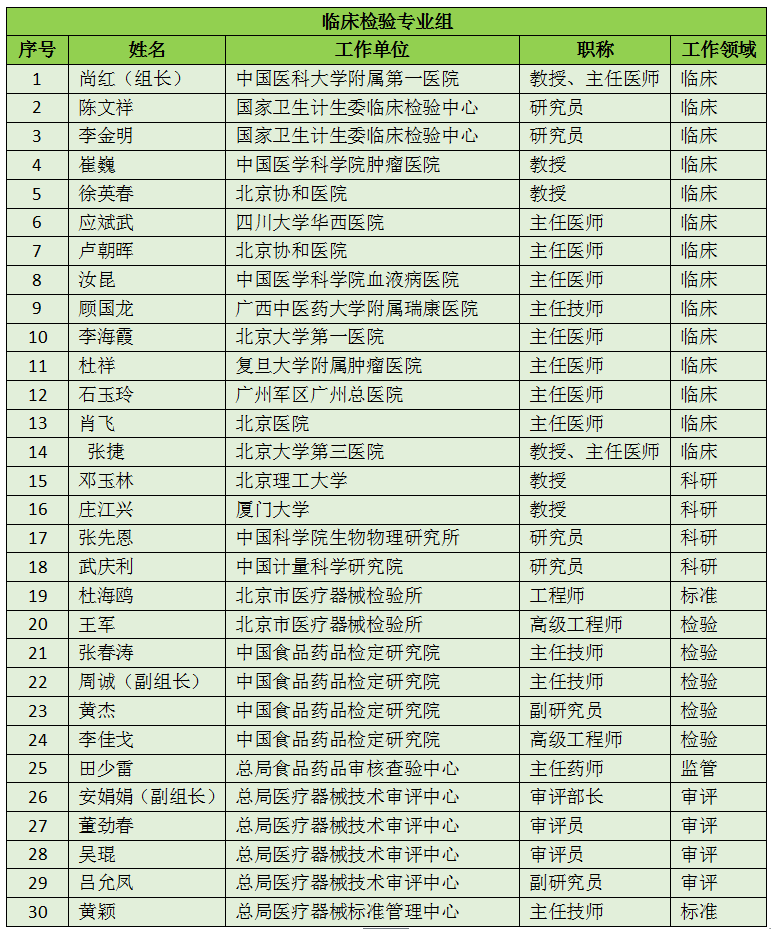
16个专业组、285名委员详细名单
此次CFDA公示的医疗器械分类技术委员会专业组委员候选人共有285名,细分为16个专业组,包括有源手术器械专业组、无源手术器械组、放射治疗和医用成像器械专业组、诊察、监护和急救专业组、物理治疗器械专业组、有源植入器械专业组、无源植入器械专业组、透析、体外循环器械专业组、注输、护理和防护器械专业组、眼科器械专业组、口腔科器械专业组、妇产科、生殖和避孕器械专业组、医用康复器械专业组、中医器械专业组、医用软件专业组以及临床检验专业组。
相关链接: