研究背景
尽管精准治疗的概念已经广泛被接受,肿瘤放疗领域却从未在这里分一杯羹。那么,能否将患者特异性的表达谱应用于放疗效果的预测呢?这个研究的作者,Scott和同事,在其既往的研究中曾经利用很多不同的细胞系做放疗敏感性实验,并且定义了一个与放疗敏感性相关的表达基因谱(AR, c-Jun, STAT-1, PKC-beta, RelA, cABL, SUMO1, PAK2, HDAC1, IRF1),并将其命名为放疗敏感指数(radio-sensitivity index)。不过,除了细胞系的研究,作者尚未将该结果应用于患者肿瘤组织标本。
这个研究做了什么?
在最新发表的研究中,作者联合应用了基于基因表达的放疗敏感性指数和线性二次模型(linear quadratic model)这两个方法产生了一个基于基因表达调控的放疗剂量(GARD)。也就是说,高GARD值代表放疗效果较好,低GARD值说明放疗效果不佳。这个GARD值可能与临床预后相关。作者针对20个瘤种的8271个原发瘤组织样品计算了GARD,(包含放疗敏感指数)。此外,作者利用五个临床群体的数据,计算了多变量Cox模型,评估GARD能否与患者预后相关。
研究结果
1. GARD数值分布
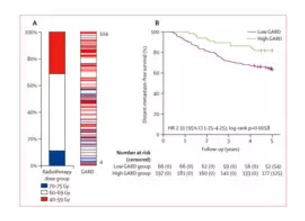
作者总共计算了20个瘤种的8271个肿瘤样本的GARD值,GARD数值分布广泛(从1.66至172.4),尽管这些患者都是接受了标准一致的放疗剂量。结果表明,从肿瘤类型来看,平均GARD数值最低的是胶质瘤,最高的是宫颈癌和口咽头颈部肿瘤。不过,每一个瘤种内的GARD分数也分布较广泛。
2. GARD预测临床结局能力
GARD数值能够独立而较准确的预测乳癌、肺癌、胶质母细胞瘤以及胰腺癌的临床结局,比这个GARD比放疗敏感指数能够更精确的预测肿瘤对放疗的效果。在Erasmus 乳癌患者群体中,GARD分值较高的患者在5年无远处转移生存期比GARD分值低的要高(HR=2.11, 95%置信区间 1.13-3.94, p=0.018),见下图。因此,可以成功的将GARD分数与患者预后关联起来。
图1. Erasmus乳癌群体中的GARD数值与5年远处无转移生存率的关系
综上,基于GARD数值的临床模型能够预测每个患者对放疗的敏感性,可以为基因指导的放疗剂量调整的临床研究提供参考和基础。
距离临床应用还有多远?
很自然地我们会问:能否将GARD应用于临床决策呢?首先,我们需要谨慎,不能将这个结果泛化到非传统的放疗领域(比如,大分割,消融放疗,术中放疗等);其次,将这个模型应用与日常的放疗决策当中仍需要更多独立的患者来验证明确;此外,还需要将这10个基因整合成qPCR检测中,以便更方便的应用于活检、冰冻或石蜡包埋组织;最后,针对每一个接受放疗的患者,我们仍然需要考虑个体化因素。值得一提的是,目前关注肿瘤异质性的治疗不仅让我们关注放疗后肿瘤形态的改变,也注意到肿瘤功能的改变,提示可以将MRI与GARD结合起来。
参考文献:
1. Jacob G Scott et al. A genome-based model for adjusting radiotherapy dose (GARD): a retrospective, cohort-based study. Lancet Oncol 2016.
2. Philip Poortmans et al. Radiation oncology enters the era of individualised medicine. Lancet Oncol 2016