小编前言
对生命理解的过程好比读一本天书:DNA双螺旋结构的提出让我们认识了天书的密码组成;通过基因组计划,我们翻译了这本天书;现在,我们正努力慢慢读懂它……
CRISPR/Cas9技术的意义在于我们不仅能利用它来读懂这本天书,还能尝试用这个技术对天书进行删减涂改,真正实现基因水平上的诊断和治疗。对于这些进步,生物学家和医学家们激动万分:我们正站在历史节点上,往前再走一步会如何,这或许难以想象。但值得我们期待,这些改变都是好的。
▲CRISPR是神奇的基因魔剪
技术引领的科技革命永远快到让人猝不及防:三年前,CRISPR技术才首次被报道在哺乳动物细胞上完成基因编辑,三年之后,这项技术已经开始应用于临床试验,治疗肺癌。上周,《自然》杂志报道确认,全球首例CRISPR/Cas9技术的人体临床试验已在四川大学华西医院正式启动,用于治疗肺癌。消息传出,舆论沸腾。一方面,一些免疫学家、医生对此振奋异常。另一方面,科学家们对于此项技术如此快地开展临床试验表示担心。本文,小编带领大家走进CRISPR,深入解读CRISPR临床试验的现状和未来。
CRISPR为什么这么火?
CRISPR/Cas9并不是第一代基因编辑技术,但一经问世,立刻完胜前两代基因编辑工具:锌指核酸酶(ZNF)和转录激活因子样效应物核酸酶(TALEN)。原因简述起来大概有这么几个:
上手快,无需很高超的实验技巧
CRISPR操作的异常简单也许是这项技术能够在各个领域快速发展的一个重要原因。任何一个有基本细胞生物学知识的研究生在经过短期细胞实验培训之后便可以依照protocol进行目的基因编辑。Cas9类型质粒可以直接从公司购买,对应的sgRNA根据自身需要设计20-30个互补序列(有软件能辅助设计,下单之后专业公司第二天就能送到)。然后将质粒共转入细胞,两三天之后就能送测序验证了。小鼠模型的构建稍微慢一点,需要2-3个月,但这个效率已经让科学家们相当满意了。
成本低廉
张锋创办的Editas Medicine;Jennifer Doudna的Intellia Therapeutics和Emmanuelle Charpentier等人联合创办的药物研发公司CRISPR Therapeutics是目前CRISPR/Cas9基因编辑技术公司的三大巨头。在国内也能轻松找到十几家具备CRISPR业务能力的生物技术公司。细胞层面上的基因编辑一次成本大概十几美元,而且还在降低。有理由相信,过不了几年,这项技术能够像PCR一样成为最基本的科技“民工技术“。
应用范围广,效率高
CRISPR技术能够顺利完成基因的敲除、敲入、敲低和碱基替换,并且从植物到动物普遍适用。利用CRISPR/Cas9对细胞系或小鼠进行基因敲除和其他应用相比效率最高,不过,还没降低到基因自然突变率(10-5~10-8)。因此,提高sgRNA的特异性,降低脱靶效率是未来CRISPR技术发展所需要攻克的难关。
CRISPR临床研究及进展
一直以来,美国一直是CRISPR前沿研究的中心。多位CRISPR技术的创始人在美国,三大巨头公司也有两个在美国(Editas Medicine和Intellia Therapeutics)。但在CRISPR的临床试验上被中国科学家抢到先机:四川大学华西医院已经率先开展基于非小型细胞肺癌的临床试验。
事实上,各大基因编辑公司和研究高校均已经开始着手布置CRISPR的临床治疗计划,2017年预计会有多项CRISPR治疗方案进入临床试验:
Editas Medicine计划于2017年初开展先天性黑朦病(LCA;一种遗传性视力衰退疾病)的CRISPR临床试验。
宾夕法尼亚大学Carl June教授主导的对多种癌症患者的T细胞进行三次不同基因编辑治疗癌症的试验也有望在明年上半年展开。
北京大学一实验室计划在3月开始利用CRISPR进行膀胱、前列腺和肾细胞癌细胞的人体试验。
Carl June教授在接受《自然》杂志的采访时称,全球已经开始了针对基因编辑临床诊疗的研发竞赛,我们已经开启“Sputnik2.0”时代(Sputnik卫星的发射直接导致了美国和苏联的航天技术竞赛)。
华西医院的临床试验:我们能期待什么?
重要的事情首先强调:本次临床试验的主要目的是检验这项疗法的安全性。华西医院选择了10位“无药可医”(化疗、放疗以及其他治疗方法均已失效)的转移性非小细胞型肺癌患者作为志愿者,取出他们血液中的T细胞,利用CRISPR-Cas9技术敲除编码PD-1蛋白的基因,再将其注射回病人体内。所有志愿者会受到长达半年的密切监护,并在此过程中接受多次细胞注射,以检验此方法是否会对病人带来益处或者严重的副作用。因此,在这个近乎等同于临床I期的试验中,没有明显的副作用就等于成功。
从现有技术瓶颈来看,最有可能出问题的环节有两个,最可怕的是CRISPR改错基因;其次是免疫细胞过度免疫。
CRISPR不可避免存在脱靶效应,如果在试验中基因没切动还好说,一个不小心改错了,后果难以预料。其次是担心敲除PD-1的T细胞过度活跃,造成自免疫疾病。尽管PD-1/PD-L1本身就是肿瘤免疫治疗的明星靶点,从目前的抗体和靶向药物研发和临床试验来看,安全性相对较高。但抗体和小分子类抑制性药物和直接的基因敲除毕竟不同,药物可以代谢,有时效,敲除PD-1的T细胞可真说不好;此外,如何控制活跃T细胞只攻击癌细胞而不是自身细胞,这个平衡也难以掌握。
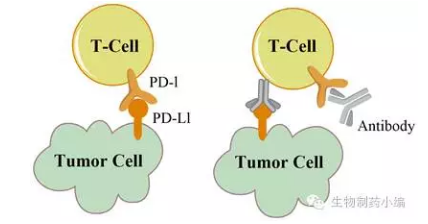
PD-1属于免疫细胞的负调控过程关键蛋白,全称程序性死亡受体1。它的主要作用就是给免疫细胞踩刹车,防止免疫细胞过度激活造成自身免疫疾病。PD-L1程序性死亡受体-配体1,顾名思义,在正常情形下,免疫细胞能够识别抗原产生抗体,并促进T细胞增殖,当PD-1结合PD-L1时就会向T细胞释放信号,降低T细胞活性。
未来的CRISPR药物长什么样?
目前CRISPR的诊疗手段设计分为两类,一类是ex vivo法,体外培育细胞,利用电穿孔技术转染包含Cas9/gRNA的核糖核蛋白,完成基因编辑后重新注入患者体内。已经或计划进入临床的CRISPR治疗均属于这一类。这类方法的好处在于操作易行可控,容易通过伦理审查。
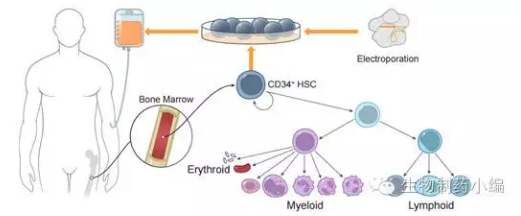
▲针对造血干细胞的基因编辑治疗血液疾病
另一类型属于in vivo法,直接通过载体将Cas9/gRNA直接输送到人体靶向组织进行基因编辑。这类方法是被普遍看好的未来CRISPR药物模式。但目前技术相当不成熟,载体的选择,如何实现Cas9/gRNA靶向输送,脱靶率问题怎么解决甚至接踵而至的伦理问题都让这一类型药物设计还仅仅是纸上谈兵。
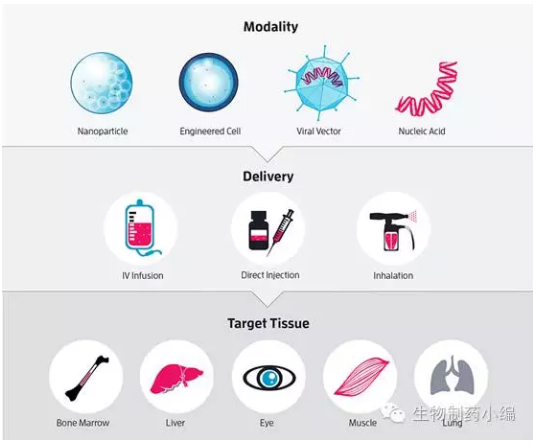
▲未来的CRISPR药物:利用纳米颗粒、工程细胞、灭活病毒、修饰核酸等多种载药途径通过注射、吸入等多种方式输送到目标组织
产业发展一日千里
Editas Medicine、Intellia Therapeutics、CRISPR Therapeutics的快速发展凸显了美国在基础研究转化方面的强大实力。CRISPR的三位主要发明人成为三家公司的技术源头,都受到资本市场的追捧。

▲从左至右:Jennifer Doudna、Emmanuelle Charpentier、张锋
Editas Medicine
2013年由张锋和Jennifer Doudna等人创立,后Jennifer Doudna由于专利之争离开Editas。
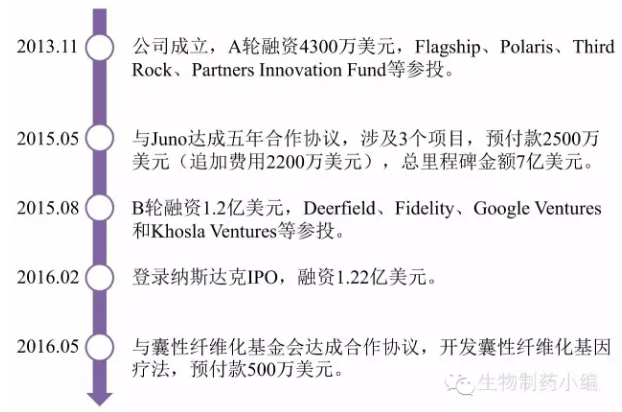
Editas发展过程历经几轮融资,于2016年2月率先登录纳斯达克进行IPO,融资1.22亿美元。
先天性黑朦病LCA的CRISPR基因疗法有望在2017年推进到临床研究。
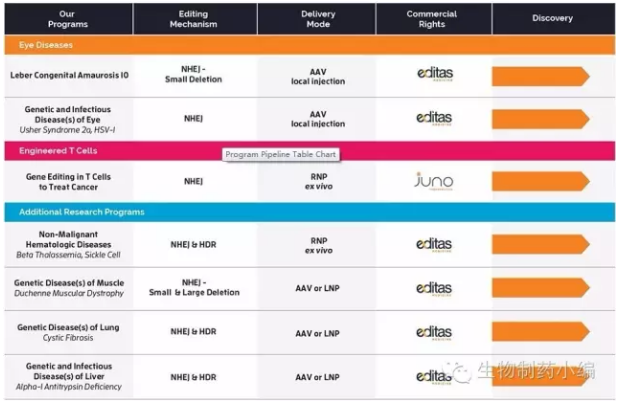
Intellia Therapeutics
Jennifer Doudna离开Editas后,将专利授权给Intellia Theaspeutics。
乘着CRISPR东风,Intellia不仅在资本市场如鱼得水,也与诺华、再生元等大中型药企开展深入合作。2016年5月,Intellia登录纳斯达克进行IPO,融资1.13亿美元。

Intellia同时开展体内与体外CRISPR疗法的研发。
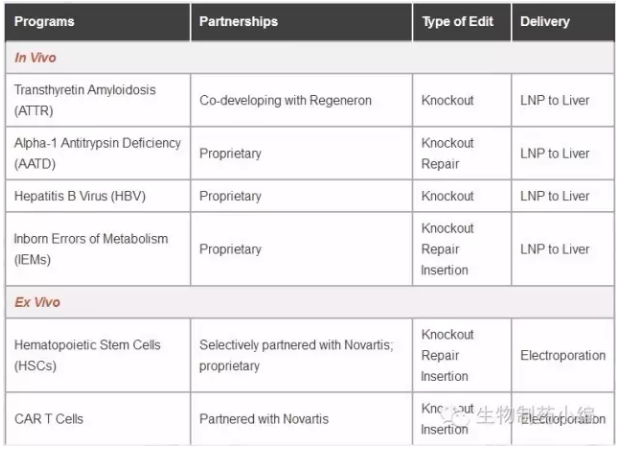
CRISPR Therapeutics
CRISPR Therapeutics的技术来自Emmanuelle Charpentier的授权。
CRISPR Therapeutics紧紧追赶Editas与Intellia,快速融资的同时与拜耳、福泰制药等开展深入合作。2016年10月,CRISPR Therapeutics递交了IPO申请,计划融资9000万美元。

CRISPR Therapeutics产品线集中在囊性纤维化(与Vertex合作)、血友病(与拜耳合作)等已经确认基因缺陷的疾病。
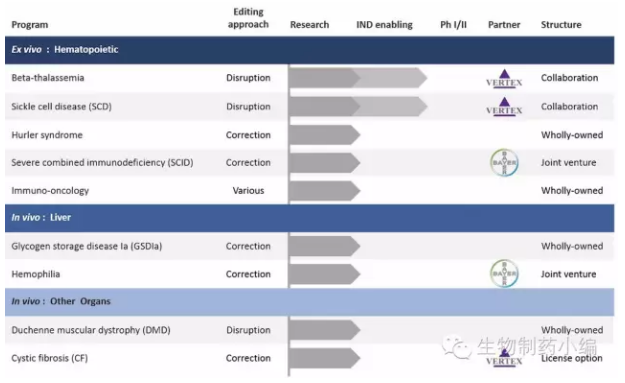
三家公司的鼎足之势已经确立,未来竞争或将更加激烈。其技术特点决定了CRISPR可与CAR-T疗法、基因疗法深入结合,给许多疾病尤其是罕见病(很多为基因突变引起)的治疗带来颠覆性的改变。
小编总结
对于CRISPR药物的前景,小编表示看好。医药行业发展到今天,精确寻找疾病产生原因和治疗靶点,实现对于特定患者的个性化精准治疗已经成为实实在在的需求,也是未来医药行业的发展趋势。“精准医疗”概念顺势提出,CRISPR药物完美契合了这一目的,从基因层面上解决病症,精确诊断,精确治疗。
当然,CRISPR药物想要继续发展还有太多关卡要过。撇开各种技术问题不论,伦理这一关估计都将举步维艰。基因组层面上的删除、替换是在追求健康极致还是在改造人?我们能不能接受为了替换父母的致病基因,利用CRISPR进行基因改造的宝宝?这些问题一旦处理不好都会造成难以预估的后果。
未来固然五彩斑斓,但在前行的路上,仍须谨慎!谨慎!谨慎!
参考资料:
Patrick D. Hsu, Eric S. Lander, Feng Zhang, Development and Applications of CRISPR-Cas9for Genome Engineering, Cell, 2014.
Eric Lander, The Heroes of CRISPR, Cell, 2016
David Cyranoski, CRISPR gene-editing tested in a person for the first time, Nature,2016.
David Cyranoski, Chinese scientists to pioneer first human CRISPR trial, Nature,2016.
Sara Reardon, First CRISPR clinical trial gets green light from US panel, Nature,2016.
https://www.editasmedicine.com/
https://www.intelliatx.com/
https://www.crisprtx.com/







