
今年6月7日,CFDA在官网发布第112号文——《总局关于整治医疗器械流通领域经营行为的公告》,旨在业自查整改之后,对所有从事第二类、第三类医疗器械经营企业进行异地交叉检查方式,以便对医疗器械流通领域违法经营行为开展集中整治。
8月19日,CFDA办公厅印发的《关于进一步加强医疗器械流通领域违法经营行为整治工作的通知》指出:截至目前,仍然存在部分省(区、市)经营企业未报送自查整改报告,部分省级、设区的市级食品药品监管部门未履行好《公告》要求的检查、督查职责,整治工作进展不平衡等问题,将进一步加强对医疗器械流通领域违法违规行为的整治力度,加强组织领导,加强监督检查。
9月8日,CFDA器械监管司下发《关于开展医疗器械流通领域违法经营行为整治工作交叉检查的通知》,并以附件形式下发了《医疗器械流通领域违法经营行为整治工作交叉检查方案》,决定从9月18日起,拿出一周时间,在全国31个省(市、区)开展医械经营交叉检查工作。
9月18日,由国家药监局组织31个省份药监局进行的医械经营跨省交叉检查正式开始了。业内经常谈飞检色变,但是,异地交叉检查又到底是怎么检查呢?和飞行检查有什么关系呢?
什么是异地交叉检查?
在各省药监局发布的具体落实政策中,也纷纷提出了采取异地交叉检查的方式进行整治。
一般来说,异地交叉检查是协同飞行检查进行的。简单来讲,就是药监局的执法人员在飞行检查的时候,不参加本县(市、区)辖区内药品医疗器械经营企业检查,作为观察员参加。这样一来,既整治了药械市场,也为药监人员提供了学习交流、取长补短的机会。
何时查?查什么?
依据最新下发的《交叉检查方案》,此次交叉检查时间则是从9月18日至23日,可视情况延长1至2天。范围是各省医疗器械经销商整治工作开展情况、以及直接现场检查。
对医疗器械经销商整,要检查企业自查整改情况,包括到期未交自查报告企业名单是否被公示了,是否将他们列为重点检查对象并进行了检查,整改企业是否跟踪检查了,吊销注销经营许可证情况,案件查处情况等。
对医疗器械经营企业,要检查是否存在第112公告中的8大违法违规经营行为。
值得一提的是,对日常管理水平低、购销渠道混乱、案件多发等问题较多,且自查发现问题少、整改措施不力的企业;从事需要低温、冷藏医疗器械经营企业;进口医疗器械境内代理商要作为重点检查对象。
此外,每个省都要现场检查7家经营企业,分别是:医械批发企业1家、零售企业1家、从事需低温冷藏医疗器械的企业1家、进口器械代理商2家、未自查或未提交报告的企业2家。
谁来检查?谁查谁?
31个省份的药监系统医疗器械监管人员会组成15个检查组,每省出2人,每组4人,由一位医疗器械监管处处长带队,到本省以外的他省去检查。
具体分配如下:
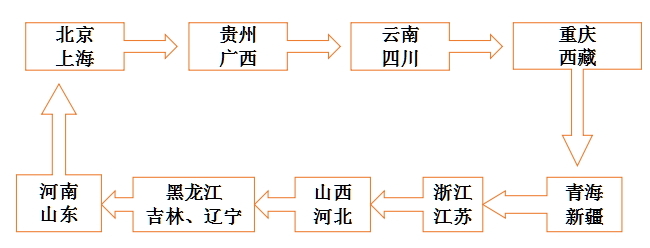
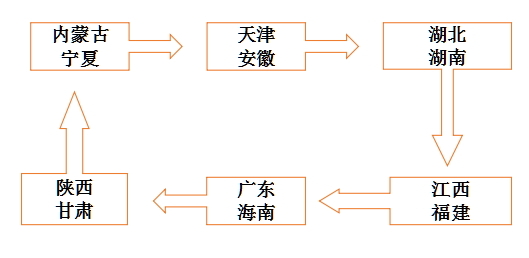
据悉,在各省(区、市)之间的交叉检查后,CFDA将于10月组织开展医疗器械经营企业飞行检查,进一步加强医疗器械经营环节的监管。
推荐阅读:







