致癌性的miRNAs(OncomiR)是肿瘤治疗的靶标之一,已有报道通过靶向miRNA来进行肿瘤治疗。由于引起肿瘤的发生是一个复杂的网络,因此,是否可以通过一次靶向多个OncomiR进行肿瘤治疗呢?今天,小编通过一篇发表在《Molecular Cancer Therapeutics》上的研究,来看看科学家们怎么使用lncRNAi的方法,通过靶向多个OncomiRs来实现HCC的精准治疗。
研究背景
肿瘤的精准医疗是现在大家关注的热点,针对小分子的肿瘤靶向治疗是热点中的热点。已有研究表明,在肿瘤发生,增殖,转移过程中,存在着大量的异常表达miRNA,称之为“OncomiR”。而这些OncomiRs通过靶向下游mRNA,调控了功能基因的转录后调控。针对肿瘤细胞中过量表达的miRNA,通过miRNA抑制剂或者antisense 序列来人为降低miRNA的表达,是可以抑制肿瘤生长的,已有的研究也是从这个方向多发,抑制某一个miRNA的表达来实现肿瘤治疗。但是,这种方法的局限性在于,由于一个miRNA可以调控多个mRNA,而一个mRNA又受到不同的miRNA的调控,如果只干预了一个miRNA的表达,通常情况下是很难实现对整个调控网络的干预而导致治疗效果不佳。针对这样一个生物学问题,本研究通过lncRNAi的方式,人为合成一条长链非编码RNA,通过同时靶向多个不同的miRNA分子,来实现对HCC的精确治疗。这个方法是否可行呢?让我们一起往下看。
研究结果
1、HCC细胞lncRNAi模型建立与确认
为了同时干预多个OncomiRs,研究人员腺病毒载体构建了同时能靶向12个miRNA(miR21,miR221/222,miR224,miR17-5p/20a,miR10b,miR106b,miR151-5p,miR155,miR181a/181b,miR184,miR1和miR501-5p),AdSVPE1a-lncR。结果显示,在HepG2,Hep3B,MHCC97H,Huh-7和PLC/PRF /5细胞系中都能表达,而在正常肝细胞系WRL-68和L02中不能表达。HepG2, Hep3B,MHCC97H, Huh-7, PLC/PRF/5 SMMC-7721, MHCC97L细胞中能检测到高的E1a表达,而在BEL-7402, WRL-68, L02细胞中表达很弱。在SMMC-7721和MHCC97L细胞中,AdSVPE1a-lncR的复制水平有成百倍,而在正常细胞系L02和WRL-68中复制水平很低。因此,研究人员成功的将lncRNAi体系在HCC细胞系中实现了表达。
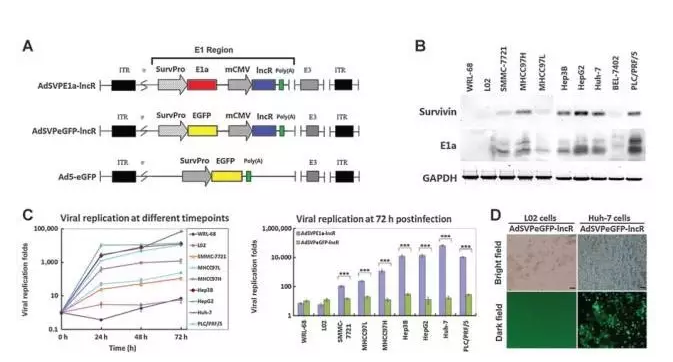
2、lncRNAi下游靶基因影响鉴定
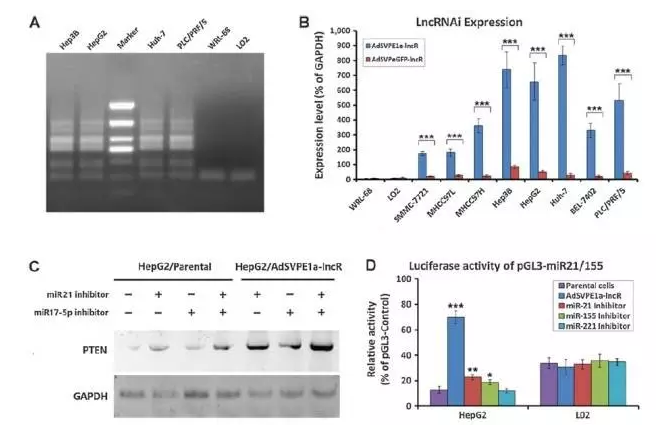
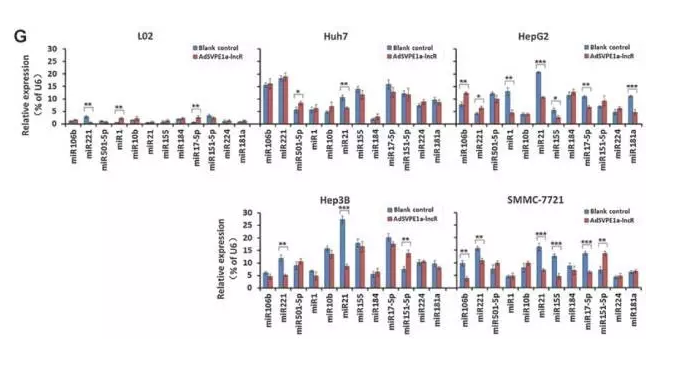
qRT-PCR检测显示,AdSVPE1a-lncR–mediated lncRNAi表达水平在Huh-7,Hep3B和HepG2细胞中比较高,在PLC/PRF/5, MHCC97H, BEL-7402,MHCC97L, and SMMC-7721相对比较低,而在WRL-68和L02细胞中很低。那么,lncRNAi是否可以影响下游miRNA及靶基因表达呢?结果显示,miR21和miR17-5p在HepG2细胞中显著抑制,相应的靶基因PTEN有明显上调。进一步的荧光素酶检测也表明pGL3-miR21/17-5p在HepG2相比L02细胞表达明显低。因此,lncRNAi可以抑制OncomiRs来保护下游靶基因。
3、lncRNAi影响HCC细胞的增殖和迁移能力
lncRNAi在细胞中能起作用,那么会影响哪些细胞的生物学功能呢?结果显示,AdSVPE1a-lncR有非常显著的Hep3B和Huh-7细胞杀伤能力。在Hep3B细胞中加入MOI=0.5 pfu/cell ,细胞存活不到50%,加入MOI=2 pfu/cell,细胞存活不到10%。在其他细胞系,HepG2,MHCC97L,PLC/PRF/5,MHCC97H和SMMC-7721细胞在加入MOI=100 pfu/cell时,存活也少于50%。但是,对BEL-7402细胞的细胞杀伤却不显著,对正常肝细胞系没有显著杀伤力。因此,lncRNAi只有对肿瘤细胞具有杀伤力,影响其增殖能力。
细胞迁移和侵袭能力检测也表明,AdSVPE1a-lncR能显著抑制HepG2, MHCC97H, PLC/PRF/5, Hep3B, Huh-7细胞的迁移和侵袭能力,而在BEL-7402, SMMC-7721, MHCC97L细胞中的抑制能力相对较弱。因此,lncRNAi显著抑制了肿瘤细胞的迁移和侵袭能力。

当HCC细胞感染AdSVPE1a-lncR后,PLC/PRF/5, Hep3B, Huh-7细胞滞留在G0-G1阶段。PLC/PRF/5 ,Hep3B细胞滞留在G2-M阶段。HepG2和 MHCC97H细胞滞留在S阶段。但是,BEL-7402, SMMC-7721, MHCC97L的细胞周期影响较弱。
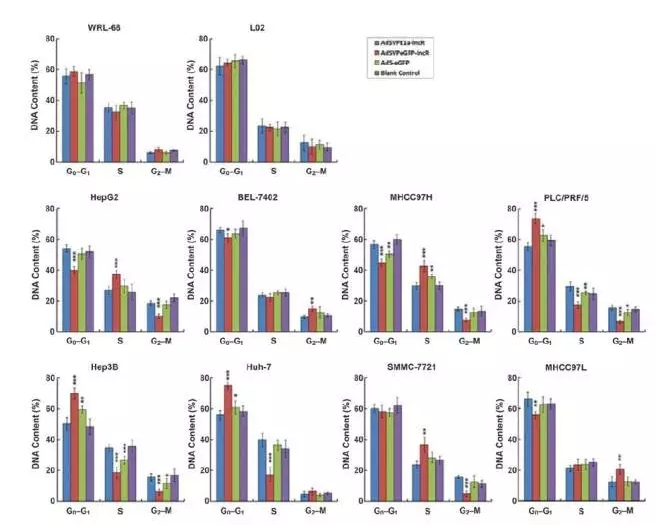
另外,在这些感染细胞中,所有细胞系的细胞凋亡比率显著增加,而BEL-7402,WRL-68和L02细胞的凋亡比率不显著。因此,lncRNAi只会影响HCC细胞的凋亡过程。

4、lncRNAi作用分子机制探究
既然HCC细胞的生物学功能发生了变化,那么,其内在的分子机制是什么呢?通过对AdSVPE1a-lncR ,AdSVPeGFP-lncR(对照)感染细胞系全基因组表达谱筛选(由上海伯豪提供),发现AdSVPE1a-lncR感染的4个不同细胞系有2091个差异基因,而AdSVPeGFP-lncR只有101个差异。其中,271个共有上调和176个共有下调基因中,上调基因主要是凋亡诱导基因和增殖抑制基因。Western blot实验也验证PTEN和p27kip1显著增加。

AdSVPE1a-lncR感染后mRNA发生变化,miRNA是否也有变化呢?通过全基因组miRNA表达谱芯片检测,研究人员发现HCC细胞中有大量的miRNA表达发生改变。
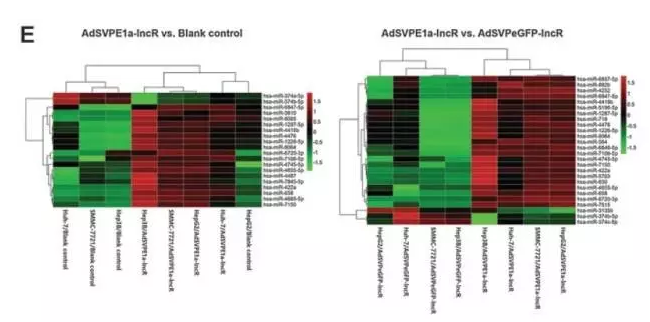
qRT-PCR显示,只有miR21在所有的HCC细胞中都表达下调。
5、lncRNAi作用效果体内实验验证
细胞实验表明lncRNAi确实对肿瘤细胞产生效果,芯片检测也表明改变的基因和miRNA也确实和增殖凋亡相关。那么,这样的效果在体内是否也一致呢?
将AdSVPE1a-lncR治疗后的Huh7和HepG2细胞移植裸鼠,21天后,治疗组肿瘤体积减小。同时,Huh-7细胞移植模型的肿瘤质量在治疗后也明显低于对照。
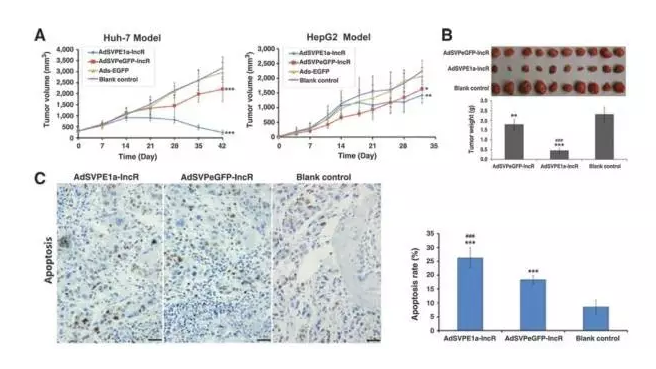
进一步的实验和免疫组化检测也表明miRNA靶基因PTEN和p27kip1表达显著增加,而CDK4,p38/MAPK,Survivin表达显著降低。
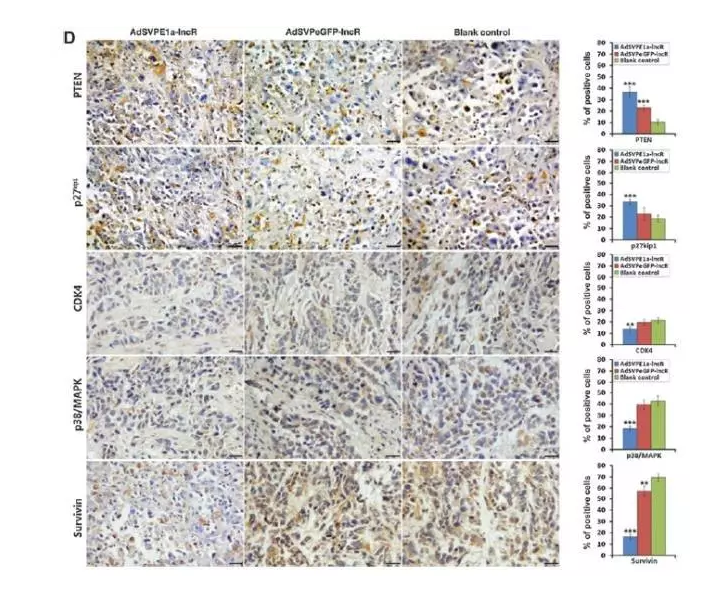
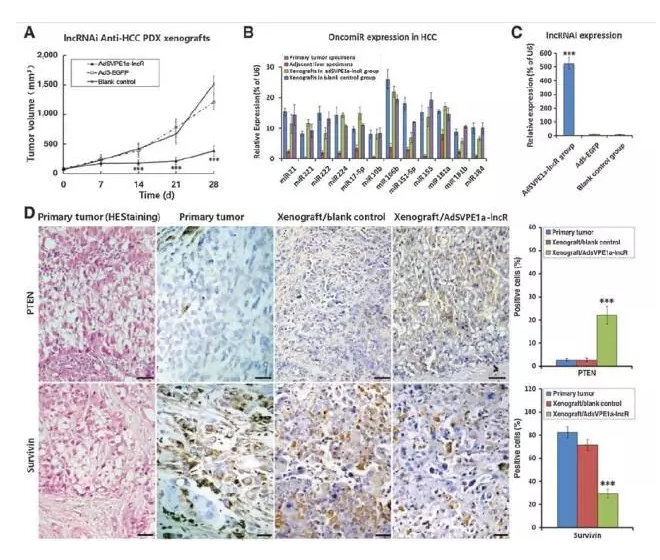
为了更进一步的确认体内作用效果,研究人员用病人样本的PDX小鼠模型进行了实验。结果显示,治疗28天后,肿瘤质量显著减少。治疗后,miRNA的靶基因PTEN表达显著增加,Survivin表达显著降低。因此,基于AdSVPE1a-lncR的lncRNAiHCC肿瘤治疗确实能够起到作用效果,是一种潜在的HCC治疗方法。
研究结论
该研究采用lncRNAi的方法,在HCC细胞中同时靶向多个高表达miRNA,从而通过保护下游靶基因实现对肿瘤的治疗,从细胞角度,基因层次和体内小鼠模型实验确实表明lncRNAi能够用来治疗HCC,该研究为肿瘤的精准医疗提供了一种新的方法,值得大家学习参考。







