2016年1月1日至今,CFDA已陆续分布了5次不予注册批件发布通知,共计941件医疗器械产品被退。近期医疗器械注册批件频频被退,到底为哪般?弗锐达小编根据近期国家局的各项通知将其归为三个主要原因。
01
清理“库存”,对发补未回的产品进行集中处理
2014年新《医疗器械注册管理办法》中规定:“技术审评机构应当一次告知需要补正的全部内容。申请人应当在1年内按照补正通知的要求一次提供补充资料……申请人逾期未提交补充资料的,由技术审评机构终止技术审评,提出不予批准的建议,国家食品药品监督管理总局核准后作出不予批准的决定。”
2015年9月22号,CMDE发布了《关于对部分发补未回的申报资料进行退审的公告》,CMDE对2014年10月1日之前发补未回的申报产品资料进行了清理、汇总。此次公示的产品中上至2005年下至2014年10月1日的产品共1154个品种,其中进口医疗器械964个品种,国产医疗器械190个品种。
2016年1月15日CFDA发出402个产品不予注册通知,1月22日发出490个产品不予注册通知。对比两次通知的清单内容可以看出,这近千件产品中绝大多数是去年9月份公示的产品清单。两个清单中被退得进口产品多达319件和397件。
2
CFDA对含有某些成分的产品重新分类界定
为解决含银盐(如硝酸银、磺胺嘧啶银等)医疗器械注册管理的有关问题,CFDA于2015年11月分布《关于规范含银盐医疗器械注册管理有关事宜的公告》(2015年第225号),对含银盐类医疗器械产品明确分类。对于含有硝酸银、磺胺嘧啶银等银盐的产品,若产品主要通过银盐的抗菌作用实现其预期用途,如含有银盐的溶液、凝胶等,不作为医疗器械管理。
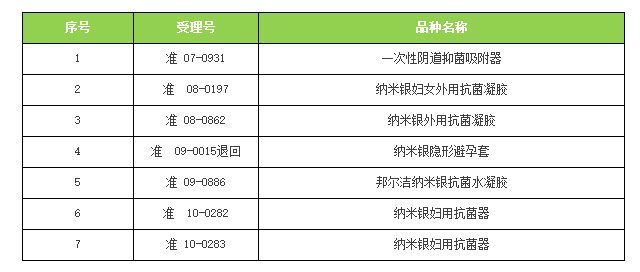
2016年02月05日CFDA发布了7个含纳米银类产品的不予注册通知。未来随着CFDA对医疗器械产品的进一步规范,对含有某些成分的产品重新分类界定,类似的不予注册通知也会越来越多。
3
产品本身不符合注册要求的
2014年新《医疗器械注册管理办法》中规定对于已受理的注册申请,有下列情形之一的,食品药品监督管理部门作出不予注册的决定,并告知申请人:
(一)申请人对拟上市销售医疗器械的安全性、有效性进行的研究及其结果无法证明产品安全、有效的;
(二)注册申报资料虚假的;
(三)注册申报资料内容混乱、矛盾的;
(四)注册申报资料的内容与申报项目明显不符的;
(五)不予注册的其他情形。
所以即便注册资料被受理了,也不要以为万事大吉,产品不符合要求还是会被退审的。加之现在医疗器械已开始收费,由企业原因造成的退审,不退注册费。以后递交注册资料的时候要更加慎重,毕竟资料不通过不但影响了产品上市的进度还浪费钱。不过,土豪请随意。







