2015年5月27日根据财政部、国家发展改革委《关于重新发布中央管理的食品药品监督管理部门行政事业性收费项目的通知》(财税〔2015〕2号)和《关于印发〈药品、医疗器械产品注册收费标准管理办法〉的通知》(发改价格〔2015〕1006号),CFDA制定了《药品、医疗器械产品注册收费标准》、《药品注册收费实施细则(试行)》和《医疗器械产品注册收费实施细则(试行)》,收费自公布之日起施行。这一举措重新开启了医疗器械产品注册收费新时代。
而在《药品、医疗器械产品注册收费标准》中明确规定二类医疗器械产品首次注册、变更注册与延续注册收费由省级价格、财政部门制定。此后,各省陆续依据该文件的精神召开专家咨询会,研究落实药品、医疗器械产品注册收费标准。但始终未见正式稿出台。
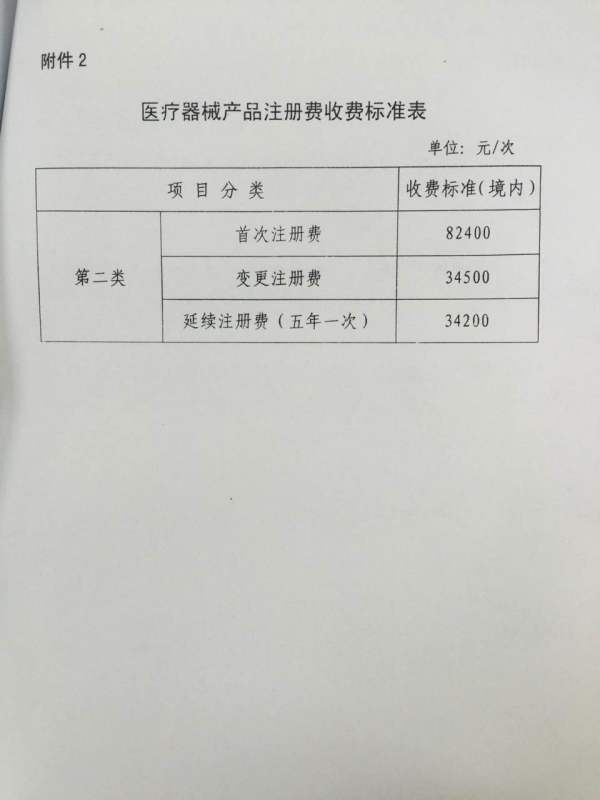
今日,小编看到一份网传的福建省的收费标准,艾玛,首次注册费82400,变更注册费34500,延续注册34200。但此份文件尚未在福建省药监局和物价局官网上公布。小编读书少,你不要骗我啊……
据此文件要求,该收费从2015年11月20日起执行(试行1年)。这就意味着,今天之后申报福建省二类医疗器械注册的产品都要开始缴费了!没有赶上末班车之前申报的企业,得去哭会儿了~


不过,从美国、欧盟等国家和地区实行医疗器械注册收费规定来看,医疗器械注册收费没有阻碍医疗器械注册的进行,反而为企业在行业内的良性竞争和发展起到了一定的促进作用。
近年来,医疗器械行业的飞速发展,政府在医疗器械的注册审评、审批及监督管理等方面花费了大量的人力、物力和财力,实施医疗器械注册收费可缓解政府行政费用负担,同时也可以发挥注册收费制度的经济杠杆作用,刺激医疗器械生产企业在研发、生产环节等过程中加强生产质量管理,提升产品质量,保障产品的安全性和有效性,促进医疗器械产品注册工作顺利进行。
在未来,生产企业要更加注重产品投入的成本和风险控制,谨慎对待每一款产品,以期少走弯路,甚至不走弯路。
当然,在国家支持“双创”的政策暖风下,各省监管部门也会为鼓励创新,制定有关“科技补贴,小微企业扶持,创新产品注册费减免”等优惠政策。我们也期待相关细则的进一步实施。







