
2014年2月7日,国家食品药品监督管理总局以食药监械管〔2014〕13号印发《创新医疗器械特别审批程序(试行)》,并于同年3月1日起施行。
依据国家食品药品监督管理总局《创新医疗器械特别审批程序(试行)》(食药监械管〔2014〕13号)要求,创新医疗器械审查办公室组织有关专家对创新医疗器械特别审批申请进行了审查,并定期公布进入特别审批程序的申请项目。
本文盘点了今年以来,截止到2015年12月1日,通过2015年创新医疗器械特别审批申请审查的21款产品;而去年同期,仅有17个产品进入快速审批通道。
2015年 第 8 号(2015-12-1)
1.产品名称:二十项耳聋相关基因检测试剂盒(微阵列芯片-飞行时间质谱法)
申 请 人:北京毅新博创生物科技有限公司
2.产品名称:迷走神经刺激系统
申 请 人:北京品驰医疗设备有限公司
3.产品名称:无框架脑立体定向手术系统
申 请 人:北京柏惠维康科技有限公司
4.产品名称:药物球囊扩张导管(商品名:ReewarmPTX)
申 请 人:微创心脉医疗科技(上海)有限公司
5.产品名称:折叠式人工玻璃体
申 请 人:广州卫视博生物科技有限公司
6.产品名称:植入型左心室辅助人工心脏
申 请 人:重庆永仁心医疗器械有限公司
2015年 第7号(2015-09-21)
1.产品名称:二尖瓣成形夹及导管输送系统
申请人:Evalve, Inc. DBA Abbott Vascular Inc.
2.产品名称:MicraTM经导管植入式无导线起搏系统
申请人:Medtronic Inc.
2015年 第 6 号(2015-08-10)
1.产品名称:呼吸道病原菌核酸检测试剂盒(恒温扩增芯片法)
申 请 人:博奥生物集团有限公司
2.产品名称:人EGFR基因突变检测试剂盒(通量测序法)
申 请 人:深圳华因康基因科技有限公司
3.产品名称:腹主动脉覆膜支架系统
申 请 人:北京华脉泰科医疗器械有限公司
4.产品名称:分支型主动脉覆膜支架及输送系统(商品名:Castor)
申 请 人:上海微创医疗器械(集团)有限公司
2015年 第 5 号(2015-06-26)
1.产品名称:血管内动脉瘤密封系统(NELLIX® EndoVascular Aneurysm Sealing System)
申 请 人:Endologix International Holdings B.V.
2.产品名称:外科生物补片(膀胱、腹壁修补专用)
申 请 人:上海松力生物技术有限公司
3.产品名称:医用人工神经移植物
申 请 人:江苏益通生物科技有限公司
2015年 第 4 号(2015-06-02 )
1.产品名称:三aPCS型角膜基质替代物
申 请 人:青岛中皓生物工程有限公司
2.产品名称:正电子发射断层成像装置
申 请 人:明峰医疗系统股份有限公司
3.产品名称:红细胞寿命测定仪
申 请 人:深圳市先亚生物科技有限公司
4.产品名称:外科手术机器人定位系统
申 请 人:北京天智航医疗科技股份有限公司
2015年 第 3 号(2015-04-13)
1.产品名称:三维心脏电生理标测系统
申 请 人:上海微创电生理医疗科技有限公司
2.产品名称:三层仿生小口径人造血管
申 请 人:武汉杨森生物技术有限公司
3.产品名称:人工晶状体
申 请 人:爱博诺德(北京)医疗科技有限公司
4.产品名称:介入人工生物心脏瓣膜
申 请 人:江苏苏州杰成医疗科技有限公司
2015年 第 2 号(2015-03-16)
1.产品名称:药物洗脱外周球囊扩张导管
申 请 人:北京先瑞达医疗科技有限公司
2.产品名称:SMN1基因外显子缺失检测试剂盒(荧光定量PCR法)
申 请 人:上海五色石医学研究有限公司
3.产品名称:全吸收式生物血管支架系统
申 请 人:Abbott Vascular
2015年 第 1 号(2015-02-02)
1.产品名称:具有精确标测肾交感神经功能的消融导管和神经刺激射频消融仪
申 请 人:苏州信迈医疗器械有限公司
2.产品名称:恒温扩增微流控芯片核酸分析仪
申 请 人:博奥生物集团有限公司
3.产品名称:儿童型智能控制洗胃机
申 请 人:天津市同业科技发展有限公司
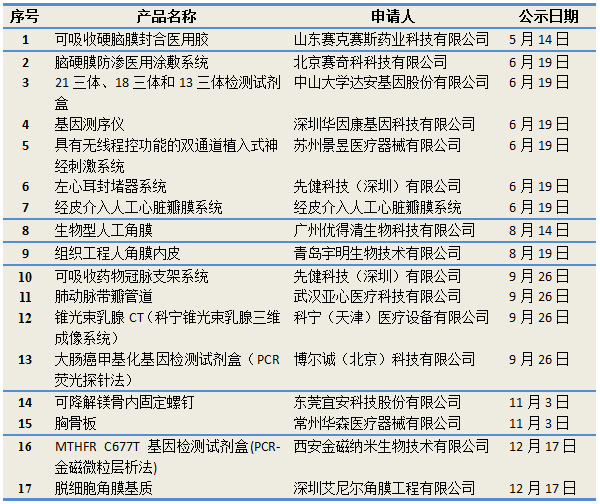
附:2014年获批进入“创新医疗器械特别审批程序”的17项产品
今年8月,国务院在国发〔2015〕44号文件中提到,鼓励医疗器械研发创新,将拥有产品核心技术发明专利、具有重大临床价值的创新医疗器械注册申请,列入特殊审评审批范围,予以优先办理。及时修订医疗器械标准,提高医疗器械国际标准的采标率,提升国产医疗器械产品质量。通过调整产品分类,将部分成熟的、安全可控的医疗器械注册审批职责由食品药品监管总局下放至省级食品药品监管部门。







