
日前,国家食品药品监管总局发布了《国家医疗器械不良反应监测年度报告(2014年)》。报告包括医疗器械不良事件报告概况、医疗器械不良事件报告统计分析、对导尿管、特定电磁波治疗仪、熏蒸类设备三种医疗器械产品安全性问题采取的措施等内容,比较全面的反映了2014年我国医疗器械不良事件监测工作情况。
统计分析显示,2014年全国医疗器械不良事件报告工作呈良好发展态势,报告数量持续增长,已突破26万份,平均百万人口报告数已达198份。其中,使用单位上报208,107份,占报告总数的78.5%;生产企业上报6,122份,占报告总数的2.3%;经营企业上报50,348份,占报告总数的19.0%;还有666份报告来自于个人;42.7%的报告涉及Ⅲ类医疗器械, 36.7%的报告涉及Ⅱ类医疗器械,18.2%的报告涉及Ⅰ类医疗器械。
一、全国医疗器械不良事件报告总体情况
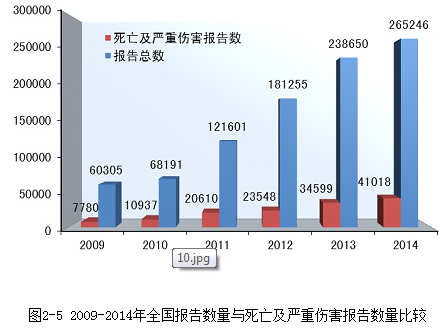
2014年全国医疗器械不良事件监测工作继续稳步发展,全年报告数已达26万份,平均百万人口报告数达198份,较2013年分别增长了11.1%和10.6%,保持着较好的发展态势;在报告数量持续增长的同时,不良事件报告质量也明显提升。
(一)可疑不良事件报告数量
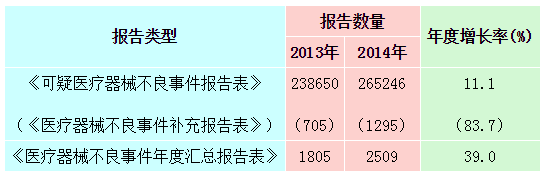
2014年,国家药品不良反应监测中心共收到《可疑医疗器械不良事件报告表》265,246份,企业后续提交的《医疗器械不良事件补充报告表》1,295份;《医疗器械不良事件年度汇总报告表》2,509份(表1-1)。
表1-1 2014年可疑不良事件报告数量与2013年比较情况
(二)死亡及严重伤害事件报告数量
2014年,国家药品不良反应监测中心共收到死亡不良事件报告98份,严重伤害事件报告40,920份,共计41,018份,占可疑不良事件报告总数的15.5%,比2013年的34,599份增长了18.6%。
(三)补充报告数量
2014年,国家药品不良反应监测中心共收到医疗器械不良事件补充报告1295份,年度增长率有了83.7%的显著提高,这表明生产企业的报告主体意识明显增强;对于器械安全性监测而言,这些来自生产企业的补充报告则提供了更为全面和准确的不良事件涉及器械的相关信息(图1-2)。
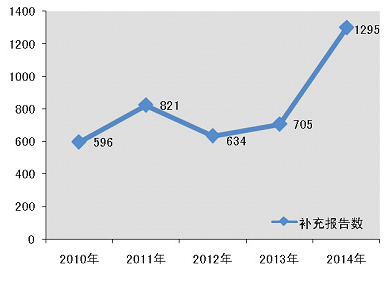
图1-2 2010-2014年全国医疗器械不良事件补充报告数量
(四)年度汇总报告数量
按照《医疗器械不良事件监测和再评价管理办法(试行)》的要求,第二、三类医疗器械生产企业应当在每年1月底前对上一年度医疗器械不良事件监测情况进行汇总分析,并填写《医疗器械不良事件年度汇总报告表》,报所在地省、自治区、直辖市医疗器械不良事件监测技术机构。
2014年,国家药品不良反应监测中心共收到医疗器械不良事件年度汇总报告2,509份,较2013年增长了39.0%;但与我国近万家的二、三类医疗器械生产企业数量而言,企业年度汇总报告率仅约为1/4,各级监测机构还需加强对生产企业的监督和指导。
(五)每百万人口平均报告数量
2014年,我国百万人口平均可疑医疗器械不良事件报告数为198份,与2013年相比增长19份,但各省间发展不平衡,报告数量差距较大。较之报告总数的增长,百万人口报告数可更好地反映报告数量的增长情况(图1-3)。
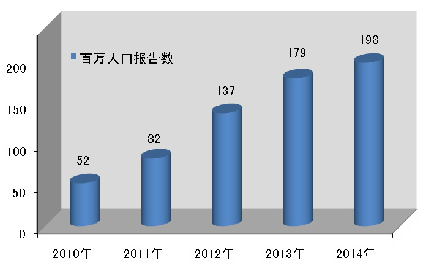
图1-3 2010-2014年全国百万人口报告数量比较
(六)注册基层用户数量
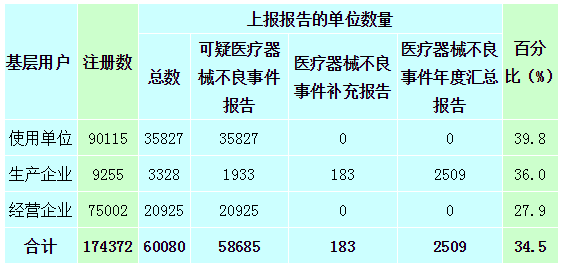
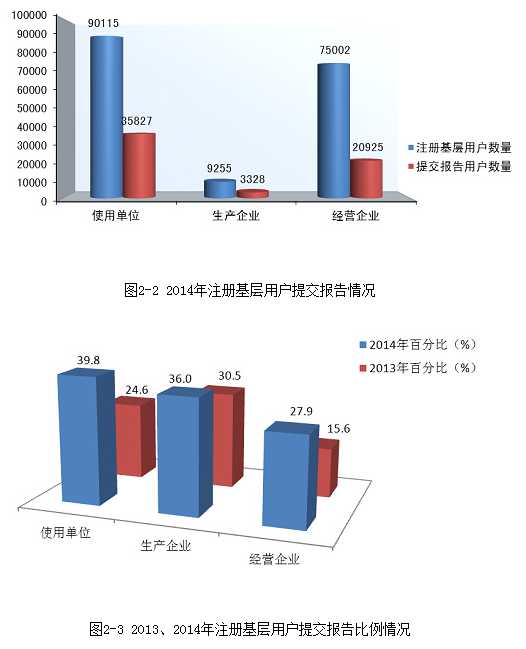
截止2014年12月31日,在全国医疗器械不良事件监测系统中,注册基层用户(包括生产企业、经营企业和使用单位)共174,372家。其中,医疗器械生产企业9,255家,占注册基层用户总数的5.3%;经营企业75,002家,占注册基层用户的43.0%;使用单位90,115家,占注册基层用户的51.7%(图1-4)。

图1-4 2014年全国医疗器械不良事件监测系统基层用户注册情况
2014年度,在174,372家注册基层用户中,提交过报告的单位数量为60,080,占34.5%,较2013年提高了13.3%。基层用户上报情况详见表1-2。
表1-2 基层用户上报报告情况
(七)2002年至2014年全国可疑不良事件报告数量
2002年1月1日至2014年12月31日,国家药品不良反应监测中心累计收到《可疑医疗器械不良事件》1000,805份(图1-5)。
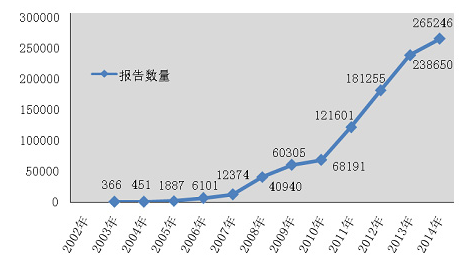
图1-5 2002-2014年全国可疑医疗器械不良事件报告数量
二、医疗器械不良事件报告统计分析
(一)按报告来源统计分析
2014年医疗器械不良事件报告中,使用单位上报208,107份,占报告总数的78.5%;生产企业上报6,122份,占报告总数的2.3%;经营企业上报50,348份,占报告总数的19.0%;还有666份报告来自于个人,占报告总数的0.3%;此外还有3份报告来源不详。
总体来看,器械不良事件报告仍主要来源于器械的使用单位。相比2013年,生产企业提交报告所占比例有所下降,与其器械使用安全第一责任人的地位不符,其履行职责的自觉性有待提高。此外,经营企业报告所占百分比也下降了3.1个百分点。
2014年,注册基层用户数量达到174,372,比2013年增长了17.4%。在所有注册基层用户中34.5%的用户提交过不良事件报告。在系统注册的9,255家生产企业用户中有3,328家提交了报告,占36.0%,比2013年提高了5.5%;注册的75,002家经营企业用户中有20,925家提交了报告,占27.9%,比2013年提高了12.3%;注册的90,115家使用单位中有35,827家提交了报告,占39.8%,比2013年提高了15.2%(图2-2,图2-3)。
(二)按事件伤害程度统计分析
2014年可疑医疗器械不良事件报告中,事件伤害为死亡的报告共98份,占总报告数的0.04%;事件为严重伤害的报告共40,920份,占总报告数的15.4%;事件伤害为其他的报告共224,228份,占总报告数的84.5)。
2014年,各类伤害程度报告的绝对数量都继续增加,其所占比例与2013年相似。总体来看,可疑医疗器械不良事件的报告数量延续了近几年的增长趋势,报告的质量及信息的可利用程度都有了较大提升。
(三)按医疗器械管理类别统计分析
2014年医疗器械不良事件报告中,涉及Ⅲ类医疗器械的报告最多,共113,220份(其中死亡及严重伤害事件报告25,398份),占总报告数量的42.7%;涉及Ⅱ类医疗器械的报告次之,共97,337份(其中死亡及严重伤害事件报告11,722份),占总报告的36.7%;涉及Ⅰ类医疗器械的报告最少,共48,152份(其中死亡及严重伤害事件报告3,381份),占总报告数的18.2%;部分报告涉及的器械管理类别不详,共6,537份(其中死亡及严重伤害事件报告517份),占报告总数的2.5%。数据显示,Ⅱ类、Ⅲ类医疗器械的报告是构成主体,这与医疗器械风险程度高低相吻合(图2-7)。
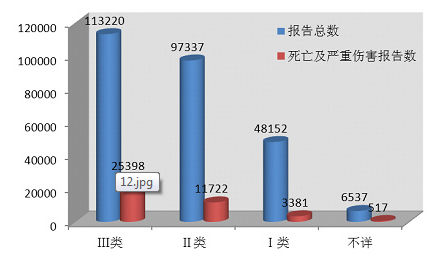
图2-7 2014年死亡及严重伤害医疗器械不良事件报告涉及产品管理类别情况
(四)按医疗器械分类产品目录统计分析
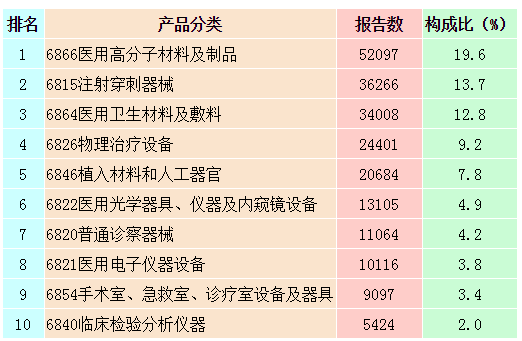
按照现行的《医疗器械分类目录》,2014年可疑医疗器械不良事件报告共涉及43类产品(除产品分类不详或未填写等其他外),涵盖了《医疗器械分类目录》中的所有医疗器械类别。其中,报告数量位列前十位的产品类别依次为医用高分子材料及制品,注射穿刺器械,医用卫生材料及敷料,物理治疗设备,植入材料和人工器官,医用光学器具、仪器及内窥镜设备,普通诊察器械,医用电子仪器设备,手术室、急救室、诊疗室设备及器具和临床检验分析仪器。与2013年相比,临床检验分析仪器取代了医用缝合材料及粘合剂成为排名第十位的产品类别,其他产品类别相同仅排名略有变化。
表2-1 2014年医疗器械不良事件报告涉及产品分类目录情况
(五)按可疑医疗器械不良事件报告数量排名前五位产品统计分析
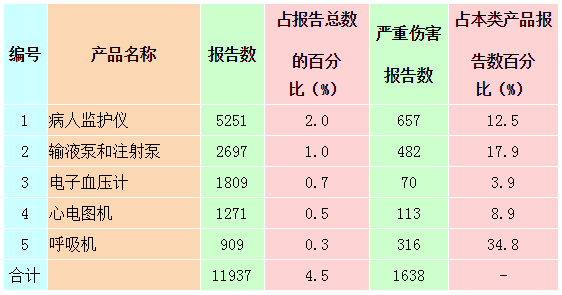
2014年可疑医疗器械不良事件报告中,报告数量排名前五位的无源医疗器械分别为一次性使用输液器、一次性使用无菌注射器、宫内节育器、角膜接触镜和静脉留置针,占总报告的32.1%,详见表2-2。报告数量排名前五位的有源医疗器械分别为病人监护仪、输液泵和注射泵、电子血压计、心电图机和呼吸机,占报告总数的4.5%,详见表2-3。
表2-2 报告数量排名前五位的无源医疗器械
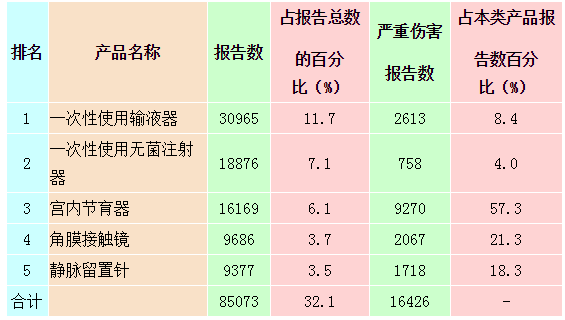
表2-3 报告数量排名前五位的有源医疗器械
(六)按涉及使用人员统计分析
2014年可疑医疗器械不良事件报告中,71.9%的报告所涉及的医疗器械是由专业人员操作的;1.7%的报告所涉及的医疗器械是由非本人的非专业人员操作的;8.8%的报告所涉及的医疗器械是由患者自己操作的,17.6%的报告操作人不详。其中由专业人员操作的报告所占比例与2013年的70.1%基本持平。现有信息提示,操作人员是分析事件发生原因时要考量的重要因素之一,而报告操作人不详所占比例偏大,提示报告质量仍有待提高。
(七)按涉及实际使用场所统计分析
2014年可疑医疗器械不良事件报告中,使用场所为“医疗机构”的报告187,766份,占70.8%;使用场所为“家庭”的报告共34,439份,占13.0%;使用场所为“不详”的报告共33,975份,占12.8%)。医疗器械的使用场所呈现多元化的趋势,使用场所的复杂性是分析不良事件发生原因时需要考量的因素之一。
备注:删除了部分不清晰的图片,完整点击原文







