3月4日国家医疗器械技术审评中心(CMDE)发布《关于医疗器械注册单元划分原则公开征求意见的通知》,分别向社会各界征询有源医疗器械、无源医疗器械、体外诊断试剂产品注册单元划分(征求意见稿)。意见截止至4月5日。
今天小编献上第二篇《无源医疗器械注册单元划分原则》(征求意见稿)
一、划分的基本原则
(一)注册单元的划分以产品的技术原理、结构组成、性能指标和适用范围为划分依据。
(二)主要组成材料不同(包括涂层材料等)的无源性医疗器械原则上应划分为不同的注册单元。作为单一整体组合使用的产品可以按同一注册单元申报。对于生物源产品,原材料来源的生物种类不同应划分为不同的注册单元。
(三)关键或特殊生产工艺(包括灭菌工艺)不同的医疗器械应划分为不同的注册单元。灭菌工艺不影响产品性能的可以作为同一注册单元。
(四)含药(活性物质)与不含药(活性物质)的医疗器械应划分为不同的注册单元。
(五)一次性使用的与重复使用的医疗器械应划分为不同的注册单元(手术工具除外)。
(六)对于配合使用、已完成同一手术目的的工具组合可以作为同一注册单元进行申报;单一类别手术工具也可以按照同一注册单元进行申报。
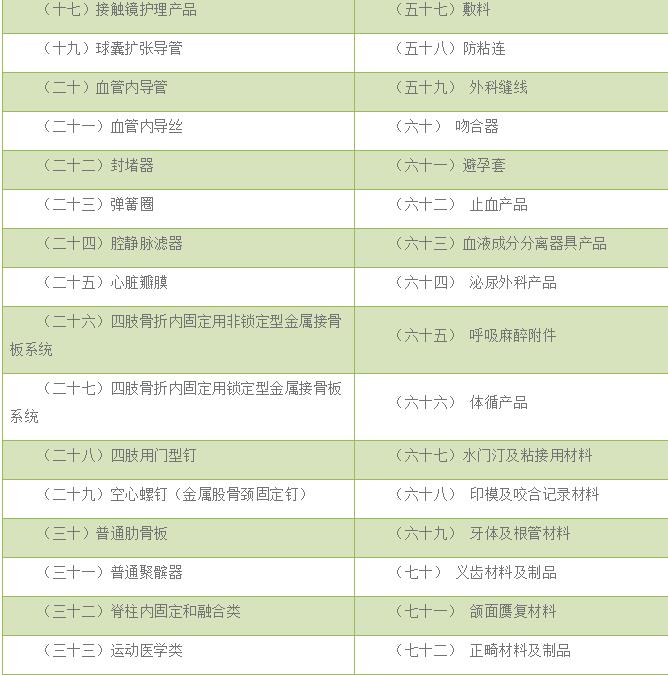
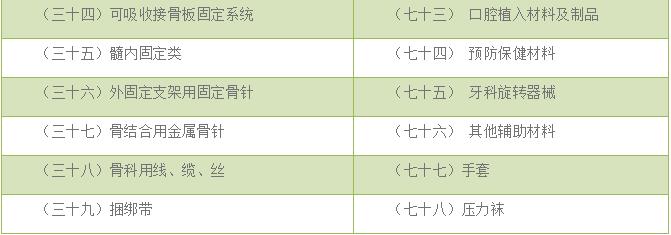
(七)以下为常见无源医疗器械单元划分举例,若申报产品未涉及下述情况,则按照上述原则进行划分。
二、常见产品注册单元划分细则

关键词:
无源医疗器械注册单元如何划分







