导语:关于阿尔茨海默症的致病机制一直众说纷纭,吸引了最多目光的“β淀粉样蛋白”假说也在Science对2006年那篇提供了关键性证据的论文的造假质疑中跌下神坛。本文则从自身免疫性疾病的角度,提出了阿尔茨海默症发病机制的新假说。
阿尔茨海默症(Alzheimer's disease,AD),俗称老年痴呆,病人的记忆与认知能力呈现进行性衰退,性格和行为都会发生改变,逐渐丧失生活能力,晚期常因感染并发症死亡。欧美国家65岁以上老年人的发病率为5%,到85岁以上发病率则达到30%以上。根据2017年全国精神疾病流行病学调查显示,我国65岁以上人群患病率为5.56%。然而到目前为止,还没有任何预防、阻止或是治疗AD的疗法。随着中国社会逐步进入老龄化阶段,老年人口持续攀升,AD也将变得越来越普遍,给家庭成员和社会带来巨大负担。
在诸多解释AD病因的理论中,“β淀粉样蛋白”假说可以说是一枝独秀,吸引了无数科研人员投身于相关的研究之中。该假说认为,淀粉样前体蛋白剪切形成β淀粉样蛋白(amyloid-β,Aβ),Aβ聚集后形成寡聚体,溶解性变差沉积成褐色斑块,导致神经原纤维缠结、神经元丢失等。Aβ在1984年被确定为痴呆症患者大脑中斑块的主要成分。2006年,发表于Nature杂志上的关键论文更是为该假说提供了有力证据,激励着后来人在这条路上孜孜以求。
然而,关于这一假说的争议也从不间断,尤其是当人们发现基于这一假说的临床治疗方案都以失败收场,更动摇了对这一假说的信心。2020年,一项发表在Neurology上的研究“Objective subtle cognitive difficulties predict future amyloid accumulation and neurodegeneration”提出,细微认知困难的神经退行性病变出现在Aβ大量沉积之前,Aβ可能不是疾病的诱因,而是疾病发展的结果。2021年一项发表在EclinicalMedicine上的研究“High cerebrospinal amyloid-β 42 is associated with normal cognition in individuals with brain amyloidosis”则提出,高可溶性Aβ多肽42的消耗导致了认知障碍发生的发生。2022年6月,Nature Neuroscience上又发表了一则题为“Faulty autolysosome acidification in Alzheimer’s disease mouse models induces autophagic build-up of Aβ in neurons, yielding senile plaques”的研究,提出神经细胞的死亡始于自噬溶酶体功能障碍,细胞外淀粉样斑块的出现要晚于细胞死亡,甚至其就是细胞的“残骸”与Aβ的混合。
不过,真正给“β淀粉样蛋白”假说带去致命性打击的,则是两个月前来自Science的打假行动。这篇在发表后的16年间被全球学者引用高达约2300次的镇圈级论文“A specific amyloid-β protein assembly in the brain impairs memory”被指出存在学术不端行为(图1),论文中70多张图片的真实性遭到质疑,此事无疑引发了AD研究圈中的一场海啸。

图1 Nature提示论文正在接受调查(图源:Nature)
但科学研究从来不是一条坦途,一处高楼倒塌,必然还有无数后来者从废墟上奋勇再起。来自多伦多综合医院的研究团队则通过对以往文献的广泛回顾综合,提出了一种新的简称为AD2的观点,认为AD并非脑部的疾病,而是脑部遭到了慢性自身免疫性疾病的攻击。研究结果以“Alzheimer's disease as an innate autoimmune disease (AD2): A new molecular paradigm”为题于2022年9月27日发表于Alzheimer's & Dementia(图2)[1]。

图2 研究成果(图源:[1])
AD2的观点认为,为了应对各种病原相关分子模式(Pathogen-associated molecular patterns,PAMP,如感染、空气污染)和损伤相关分子模式(Damage-associated molecular patterns,DAMP,如创伤、缺血、抑郁、肥胖)的免疫刺激事件,Aβ作为早期免疫肽被合成释放,触发先天免疫级联反应,Aβ的免疫调节特性增强了小胶质细胞的持续活化和促炎细胞因子的持续释放,从而导致非特异性自身炎症,致使凋亡性神经元死亡,而在这过程中,旁观者神经元也被杀死。AD2仍认为Aβ是模型中重要的参与者,但不同于“β淀粉样蛋白”假说的是,AD2把Aβ视作一种挥发免疫调节和抗菌作用的免疫肽,只是AD免疫病理框架下复杂庞大的体系的一部分。
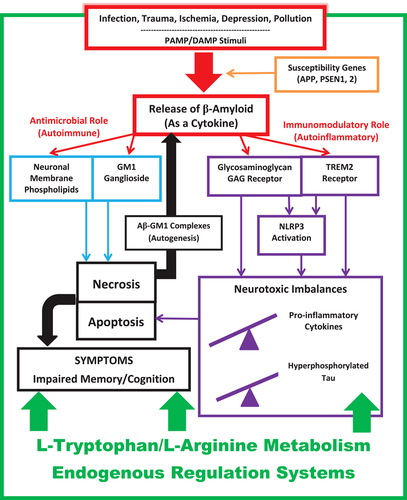
图3 AD2模型(图源:[1])
其主要观点如下:
1 Aβ是一种免疫肽
大量数据支持将Aβ识别为抗微生物肽(Antimicrobial peptides,AMPs,也称为宿主防御肽),且Aβ满足细胞因子的分类标准。AMPs和细胞因子是大脑中必不可少的固有肽,具有抗菌和免疫调节双重功能,寡聚或聚集是其正常功能的一部分,而非病理过程。这对于Aβ也是如此。
2 Aβ的抗菌作用具有神经毒性
AMP通过库仑力与入侵微生物相结合,而细菌的跨膜电位以及利用离子通道和电脉冲进行通信等特点和神经元类似。这就导致Aβ也能攻击神经元。淀粉样变性代谢途径产生更具神经毒性的Aβ1-42。Aβ的抗菌作用还能将线粒体病变和金属平衡失调的作用纳入AD2模型中。
3 Aβ在神经毒性中的免疫调节作用
Aβ与TREM2–GAG–NLRP3系统的免疫调节相互作用,产生促炎症级联反应,过度的促炎小胶质细胞活性激活导致非特异性的旁观者细胞毒性。由于突触膜和细菌类似,更容易受到Aβ/AMP的直接攻击,AD表现出的突触毒性也就变得可以理解了。同时,Aβ与TREM2–GAG–NLRP3系统的作用抑制了TREM2、GAG和NLRP3受体对正常突触功能、可塑性和弹性过程的促进作用,导致异常的突触修剪和额外的突触丢失。
4 AD是一种慢性自身免疫性疾病
Aβ的免疫反应的慢性性来自于Aβ的抗菌作用,坏死神经元随后的分解产物中包括释放单唾液酸四己糖神经节苷脂(monosialotetrahexosylganglioside,GM1)-Aβ分子复合物,该复合物扩散到附近神经元,引发进一步释放Aβ,从而导致慢性、自我持续的自身免疫循环。此外,患者最终血脑屏障遭到破坏,来自脑外的巨噬细胞将进一步加剧疾病发展。
5 L-色氨酸和L-精氨酸的作用
免疫过程受到严格的内稳态调节,先天免疫和适应性免疫都有内源性控制系统。过去的研究将L-色氨酸和L-精氨酸描述为先天免疫的“控制者”,L-色氨酸和L-精氨酸被证实是Aβ低聚化的直接抑制剂,并且L-色氨酸水平的降低与认知功能障碍增加或更易得AD相关,小鼠模型中改变L-精氨酸和一氧化氮水平能改善认知能力下降。
6 Aβ的“脱靶”非免疫效应
和其他细胞因子和免疫肽一样,Aβ构象灵活,不仅与免疫受体结合,而且与一系列非免疫受体结合。Aβ的这种受体结合异质性增加了AD病理学的多样性及其多种免疫病理机制的复杂性。
AD2模型不仅解释了AD相关疾病过程的启动和进展,还为未来开发诊断、治疗方案提供了候选的一般靶点(自身免疫)和特定靶点(L-色氨酸代谢、L-精氨酸代谢),比如通过测量患者血清或脑脊液中的L-色氨酸或L-精氨酸代谢物水平进行诊断,或是设计组合疗法对抗AD多重且相互之间存在串扰的发病机制,调整已知药物并加以重新利用也是值得考虑的做法。
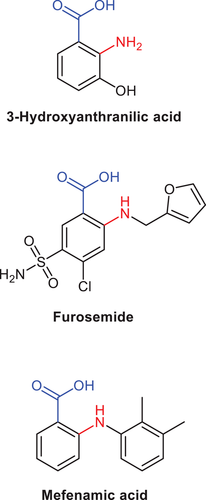
图4 重新调整已知药物的用途(图源:[1])
鉴于AD的复杂性,AD2模型仍然存在一些局限性,比如难以反应AD患者与患者之间、早发与晚发疾病之间的临床异质性,也不能很好地解释神经化学变化的发生与首次症状出现之间长达数十年的时间间隔。但AD2模型提出了一个广泛包容的框架,将多种不同的理论统一为一个全面的解释,提示最终的治疗可能需要理性的多党派,而不是一颗“魔法子弹”。
参考资料:
[1]Donald F. Weaver. Alzheimer's disease as an innate autoimmune disease (AD2): A new molecular paradigm. Alzheimer's & Dementia, 2022; DOI: 10.1002/alz.12789