导语:9月20日,专注于发现和开发下一代TCR-T细胞疗法的临床前生物技术公司ImmunoScape,宣布其完成1400万美元的新一轮融资。本轮融资由现有投资者Anzu Partner领投,新投资者Amgen Ventures和新加坡的全球投资者EDBI参投。所融资金将被运用在加速疗法开发,以及推进候选疗法进入临床。
近年来,在实体瘤治疗领域,以CAR-T疗法为代表的新型免疫疗法取得了前所未有的突破。在这其中,TCR-T疗法也初露锋芒,由于其可治疗靶点范围更广,TCR-T在实体瘤治疗领域的潜力值得期待。
细胞受体基因工程改造的T细胞疗法(TCR-T疗法)是通过向普通T细胞中转导嵌合抗原受体或者TCRα/β异二聚体,来提高特异性识别肿瘤相关抗原的T细胞抗原受体的亲和力和免疫细胞的战斗力,进而引导T淋巴细胞发挥较强的免疫杀伤效果。TCR-T细胞疗法在实体瘤的治疗中前景向好,在CAR-T疗法蓬勃发展的同时,TCR-T疗法的相关研究也正如火如荼地进行。近日,ImmunoScape完成了1400万美元融资,以促进癌症特异性T细胞受体的发现和表征。
发现罕见癌症特异性T细胞,ImmunoScape
获得1400万美元融资
ImmunoScape是一家专注于发现和开发下一代TCR-T细胞疗法的临床前生物技术公司,旗下所拥有的深度免疫组(Deep Immunomics)平台利用其专有的组合条形码技术,能够以高分辨率发现和深入表征罕见的癌症特异性T细胞及其T细胞受体。其灵敏度极高,可以识别出现频率仅有0.001%的抗原特异性CD8阳性T细胞[1]。这一平台能够同时评估数百名癌症患者血液样本中的数千个T细胞,以识别罕见的临床相关T细胞克隆,然后对相应的TCR进行评估和优先排序,以构建不同的TCR-T细胞疗法组合。

与样本类型无关,Deep Immunomics平台能够从外周血和肿瘤浸润淋巴细胞中挖掘T细胞。其专有的靶标筛选平台TargetScape通常使用胎-MHC编码系统与大型抗体组进行高通量筛选,识别出数百个候选T细胞。这些被筛选出来的候选T细胞会进一步进行单细胞测序,对其TCR序列、表型、基因表达量进行分析。对识别出来的TCR靶标进一步开发,通过体内和体外模型分析其功效、安全性和有效性。
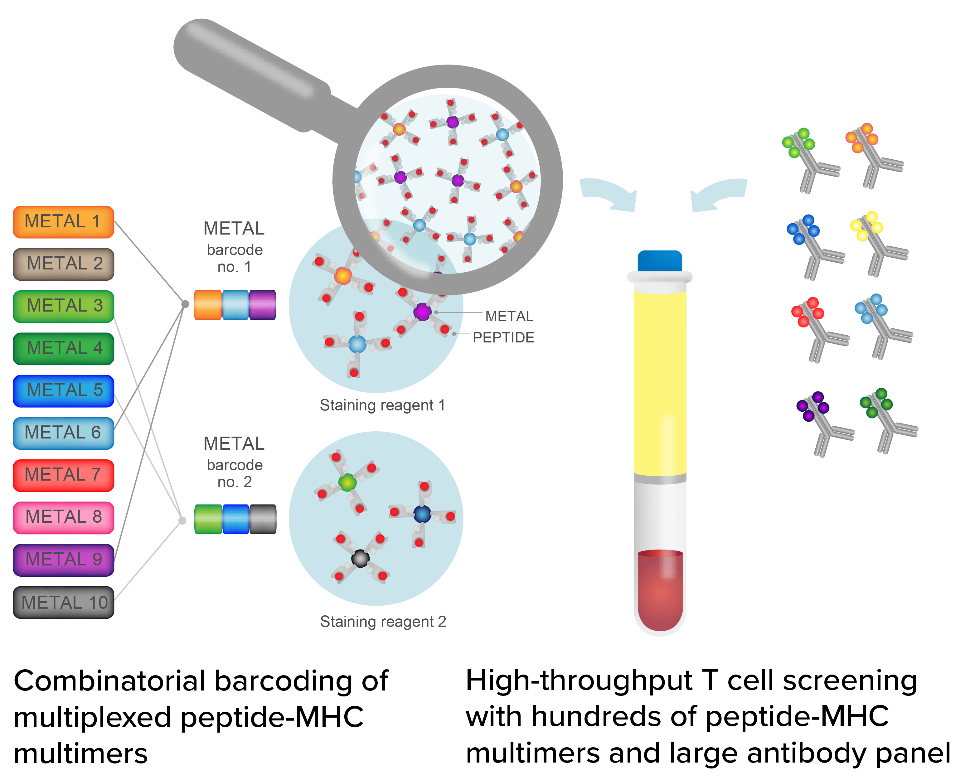
图1 靶标筛选平台TargetScape(图源:ImmunoScape官网)
也就是说,通过利用计算生物学和机器学习,以及对T细胞克隆的高通量筛选和评估,ImmunoScape能够有效识别新的T细胞治疗靶点和TCR候选者,其已经使用病毒特异性T细胞广泛验证了计算平台,并正在应用相同的方法来构建广泛的癌症特异性TCR产品组合。
ImmunoScape首席执行官Choon Peng Ng表示:“我们在发现计划中取得了重大进展,并使用深度免疫组学平台Deep Immunomics确定了几个引人注目的临床TCR候选者。所筹集到的资金将使我们的开发工作加快,助力推动治疗候选药物进入临床。我们非常高兴获得Amgen Ventures的支持,期待与他们的团队合作,利用ImmunoScape的技术解决重要且尚未满足的医疗需求。”
Amgen Ventures副总裁Philip Tagari表示:“Amgen Ventures致力于投资有前景的解决方案,以应对医疗保健面临的最大挑战,尤其是那些提供独特的、基于价值的方法的解决方案,这些方法与我们为患者提供服务的使命一致。随着我们继续开发下一代创新药物,ImmunoScape的深度免疫组学和机器学习平台有可能帮助发现新的治疗方案。很高兴与ImmunoScape的团队合作,释放其技术的全部力量。”
“肿瘤克星”之TCR-T,在实体瘤治疗中初露锋芒
2006年,Morgan等人首次报道了使用MART-1特异性TCR-T细胞治疗黑色素瘤,客观缓解率为12%,证明了TCR-T淋巴细胞治疗在临床应用中的可行性。2011年,Robbins等人首次证实了针对NY-ESO-1的特异性TCR-T细胞对黑色素瘤和滑膜肉瘤患者的临床疗效,滑膜肉瘤组的客观缓解率为61%,黑色素瘤组的客观缓解率为55%[2]。
2014年,Rosenberg团队治疗了一名患有ERBB2IP点突变的晚期难治性胆管癌患者,接受新抗原反应性免疫细胞的输注后,患者生存时间显著延长,病情得到持续缓解,在学术界引起轰动。此后,TCR-T细胞治疗的靶点扩展到个体化新抗原,多靶点反应性T细胞通过整合多种抗原信息,可以同时识别多种抗原,在一定程度上提高T细胞的抗肿瘤作用。
对健康组织既没有出现靶向自身免疫毒性,也没有出现非靶向交叉反应。新抗原TCR-T细胞治疗实体肿瘤,比如黑色素瘤、转移性结直肠癌、胶质母细胞瘤、转移HPV16阳性宫颈癌、肛门癌、口咽癌和阴道癌,取得了令人满意的结果。以上表明,TCR-T在实体瘤治疗领域显示出了巨大的治疗潜力和优势。
实体瘤杀器TCR-T,距离临床应用还有多远?
与CAR-T相比,TCR-T能更好地浸润实体瘤,对抗原的敏感度极高,表明TCR-T在实体瘤治疗领域具备更显著的优势。尽管TCR-T在临床前和临床研究中表现出了巨大的治疗潜力,但是其依然存在诸多不可避免的挑战。
■ 缺乏合适的新抗原靶点
选择新的安全的靶点,是肿瘤免疫治疗中面临的最大挑战。第一,低新生抗原负荷和MHC下调使肿瘤细胞失去新抗原靶点。突变负荷低的癌症,新抗原很少或根本不存在,因此无法进行新抗原特异性TCR-T的后续研究。一些肿瘤具有免疫逃避现象,如HLA下调和新抗原丢失,导致肿瘤细胞表面缺乏T细胞识别靶点。第二,缺乏通用新抗原靶点。针对新抗原的特异性T细胞治疗技术的临床应用仅限于病例报告,不具有普遍应用价值。由于缺乏通用新抗原靶点,新抗原靶向TCR-T细胞治疗的成本对每一个患者来说都是一个新的挑战。第三,HLA的限制将限制TCR-T的应用。目前的TCR疗法依赖于匹配的HLA,但很多患者存在HLA分型局限性。
■ TCR基因转移中的脱靶和安全问题
由于工程化TCR-T细胞无法区分肿瘤细胞和表达靶抗原的正常细胞,因此TCR-T细胞免疫可能会严重损伤相应的正常组织。TCR疗法治疗期间的脱靶事件可能是由含有两条α链和两条β链的异二聚体之间的自身/交叉反应引起的,这可能导致新的自身免疫特异性。TCR二聚体依赖性混合毒性也可能成为临床应用中的安全问题[3]。
■ 肿瘤抗原异质性与肿瘤免疫逃逸
癌症相关抗原的表达在肿瘤内的不同细胞中有所不同,这使得一些肿瘤细胞能够逃避特定的抗原靶向治疗,并导致一些接受免疫检查点抑制剂和过继性 T 细胞治疗的患者出现治疗耐药性。肿瘤免疫逃逸是指肿瘤细胞通过各种机制避免被免疫系统识别和攻击而在体内存活和增殖的能力。实体瘤的特点是复杂的免疫抑制微环境和内在异质性,使得持久的TCR-T诱导反应变得困难[3]。
除了以上三个问题,TCR-T还面临T细胞无反应和衰竭、细胞因子风暴引起的毒性等挑战。
综上所述,TCR-T在治疗实体瘤方面还是具备显著优势的,但是其也依然存在很多不可避免的问题。相信随着各项技术的发展,这些挑战会被逐一解决,届时TCR-T细胞疗法一定会成为“抗癌利器”。
参考资料:
[1]https://immunoscape.com/immunoscape-raises-14m-to-facilitate-the-discovery-and-characterization-of-cancer-specific-t-cell-receptors/
[2]Xu R, Du S, Zhu J, et al. Neoantigen-targeted TCR-T cell therapy for solid tumors: How far from clinical application. Cancer Lett. 2022 Oct 10;546:215840. doi: 10.1016/j.canlet.2022.215840. Epub 2022 Jul 31. PMID: 35921969.
[3]Liu Y, Yan X, Zhang F, et al. TCR-T Immunotherapy: The Challenges and Solutions. Front Oncol. 2022 Jan 25;11:794183. doi: 10.3389/fonc.2021.794183. PMID: 35145905; PMCID: PMC8822241.