摘要:有一种化学物质,你可能不知道它的名称,但却可能每天都在不断摄入。这种物质被科学界称为“永久化学物质”,因为人体无法代谢,它一旦进入人体便很难被排出,而且在体内不断累积,造成生理毒性。这种物质由于其持久耐用的属性以及抗污渍、耐热、抗油等属性,广泛应用于我们的生活品中,包括:不粘锅、食品包装(防油纸、快餐盒、包装纸等)、个护产品(洗发水、牙线、指甲油、粉底和眼妆等)、防水面料衣物、家具抗污涂层(油漆、密封剂等)以及一些防火材料。
多氟烷基物质和全氟烷基物质(Poly-and perfluoroalkyl substances,PFAS)是人们日常生活中普遍应用的化学物质,已作为工业和消费品广泛使用60多年(图1)。PFAS无处不在,广泛存在于我们的日用品中,并通过迁移进入人体。最典型的案例如不沾炊具,其表面不沾涂层可在高温下分解为PFAS,并随食物进入人体;食品包装和一次性纸杯的内涂防水层含有的PFAS也会随着食物迁移进入人体;56%的粉底和眼部产品、47%的睫毛膏、48%的唇部产品都含有PFAS,并迁移入人体。目前,在美国成年人的血液中PFAS的检出率超过98%。
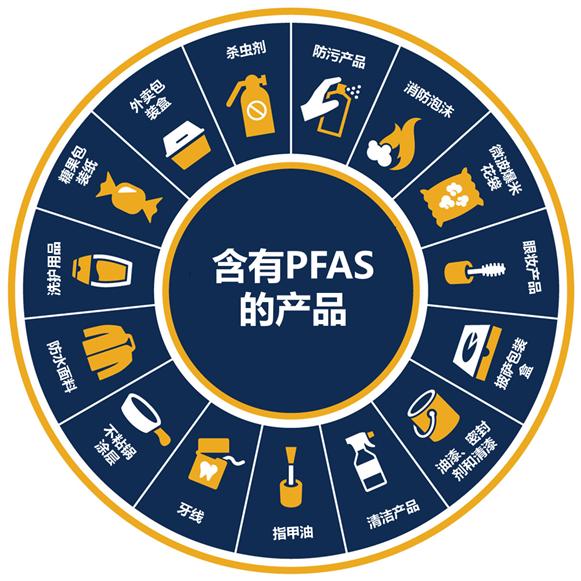
图1 含有PFAS的产品(图源:生物探索)
20%中国城市饮用水PFAS浓度超污染上限
2021年,清华大学研究团队在Environmental Sciences Europe发表题为“Per- and polyfluoroalkyl substances (PFASs) in Chinese drinking water: risk assessment and geographical distribution”的研究成果(图2)[1]。研究结果表明超过20%的城市饮用水样本中PFAS浓度超过最大污染物标准上限,长江流域的一些城市PFAS已经超过欧美机构发布的健康标准。PFAS浓度最高的城市依次为:自贡、连云港、常熟、成都、无锡和杭州。

图2 研究成果(图源:[1])
此项研究从中国66个城市(4.52亿居民)中随机取得526份饮用水样本。调查结果表明饮用水中PFAS浓度最高的城市为:自贡(502.9 ng/L)、连云港(332.6 ng/L)、常熟(122.4 ng/L)、成都(119.4 ng/L)、无锡(93.6 ng/L)和杭州(74.1 ng/L)。四川省饮用水PFAS浓度一枝独秀,而华东地区城市饮用水密集分布高浓度PFAS,环渤海一带也是PFAS重灾区(图3)。研究认为,造成这种高浓度PFAS地域分布的原因很可能是附近的工业源头,特别是氟化工厂、皮革、纺织和造纸等行业。目前,中国尚无饮用水中PFAS含量的相关指南,但是浓度远超美国环境保护总署2016年发布的非强制执行的健康建议值70 ng/L。
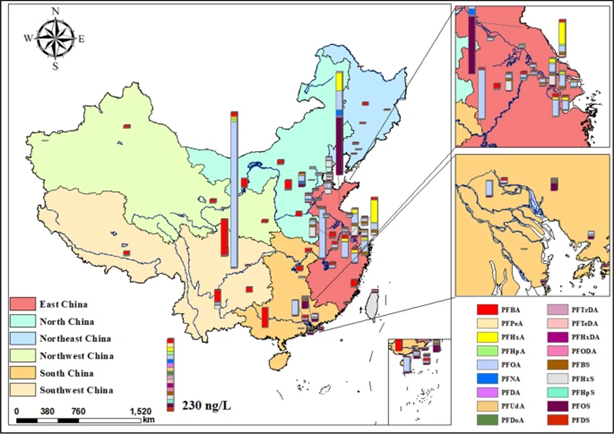
图3 城市饮用水PFAS抽样调查地图(图源:[1])
PFAS:沉积在体内多器官,持续产生生物毒性
2021年,密歇根大学Sung Kyun Park教授在美国糖尿病协会年会表示:“PFAS被人体吸收后,首先在体内与血清蛋白结合,然后沉积在肝脏、肾脏和睾丸等身体各个脏器中,无法排出,造成多种毒性(表1)。快餐包装也含有大量PFAS,包装比快餐本身对你的健康还要有害。”
表1 PFAS的生物毒性
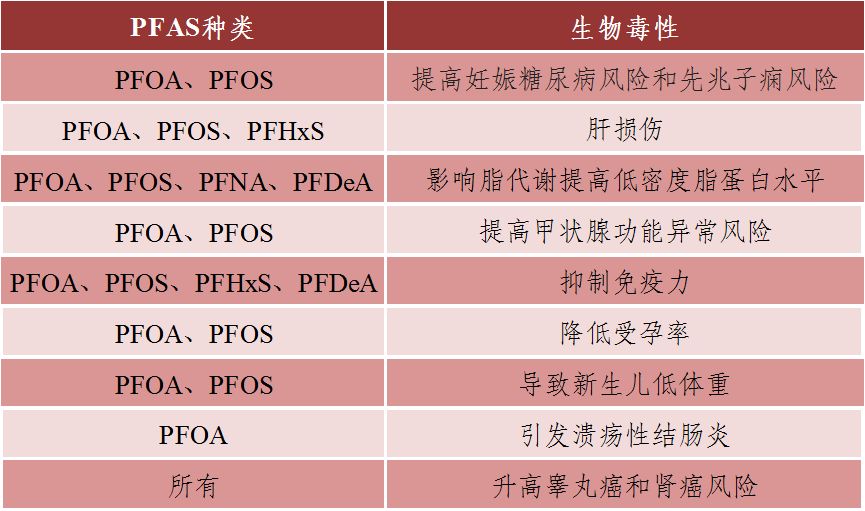
数据来源:2021年美国糖尿病协会年会丨制表:生物探索编辑团队
注:全氟辛烷磺酸(Perfluorooctane sulfonate,PFOS)、全氟辛酸(Perfluorooctanoate,PFOA)、全氟己烷磺酸(Perfluorohexane sulfonate,PFHxS)、全氟壬酸(Perfluorononanoic acid,PFNA)、全氟癸酸(Perfluorodecanoic acid,PFDeA)。
JHEP:多个种族的人群均存在PFAS致肝癌的高风险
PFAS是科学界公认的内分泌干扰物,具有肝毒性。PFAS进入体内后会优先分配到“解毒器官”-肝脏,由于肝脏无法代谢PFAS,累积的PFAS会改变肝脏脂质、氨基酸和碳水化合物的代谢,具有肝毒性和代谢破坏作用。研究表明暴露于PFAS的啮齿动物,即使是低水平的PFAS,也会导致动物出现肝脏肿大、肝细胞肥大、肝酶升高和肝脂肪变性;在虹鳟鱼中,PFAS会增加肝细胞腺瘤和肿瘤的发病率;在成人中,PFAS与细胞角蛋白18的改变有关,细胞角蛋白18是肝细胞凋亡的标志物;通过肝脏磁共振成像或肝活检诊断出PFAS与儿童和成人的非酒精性脂肪性肝风险增加有关。此前,人类PFAS暴露与肝细胞癌之间的关联尚无报道。
2022年8月8日,南加州大学诺里斯综合癌症中心研究团队在JHEP Reports发表题为“Exposure to perfluoroalkyl substances and risk of hepatocellular carcinoma in a multiethnic cohort”的研究成果(图4)[2]。研究结果表明暴露于高水平PFOS与肝细胞癌风险增加4.5倍相关,致癌的机制可能是通过改变葡萄糖、氨基酸和胆汁酸代谢。

图4 研究成果(图源:[2])
此项研究旨在探索PFAS暴露与代谢途径改变和非病毒性肝细胞癌(Hepatocellular carcinoma,HCC)风险之间的关联。在这项嵌套病例对照研究中,对来自多民族队列研究(Multiethnic Cohort Study,MEC)的50例HCC病例和50例单独匹配的对照进行了诊断前血浆PFAS和代谢组学测量。病例/对照按年龄、性别、种族和研究区域进行匹配。使用条件逻辑回归检查PFAS暴露和HCC风险。对PFAS暴露和HCC风险进行了代谢组广泛关联研究和途径富集分析,并使用中间方法确定了关键代谢物/代谢途径。
结果发现:
1 血浆PFOS提高4.5倍HCC风险
血浆PFAS浓度与HCC风险之间呈正相关,其中PFOS和HCC的关联最强:血浆PFOS浓度>54.9 μg/L与HCC几率高4.5倍相关;此外,血浆中大于1.22 μg/L的PFUnDA水平与2.2倍高的HCC几率相关。
2 PFOS导致肝癌的途径与四种物质代谢相关
使用代谢组广泛关联(Metabolome wide associations,MWAS)检查了高水平PFOS与血浆代谢组之间的关联。在MWAS中包含的4361项代谢组学特征中,433项(9%)与高水平的PFOS暴露相关,6种代谢物与PFOS暴露相关。MWAS的功能途径分析确定了18种代谢途径的显著富集。这些途径主要与氨基酸的代谢、碳水化合物的代谢以及聚糖的生物合成和代谢有关。
PFOS和HCC均富集了五种代谢途径,包括色氨酸代谢、硫酸角蛋白、硫酸肝素、硫酸软骨素和N-聚糖降解。此外,四种代谢物与PFOS暴露和HCC风险呈正相关,包括葡萄糖、丁酸(一种短链脂肪酸)、α-酮异戊酸(一种支链α-酮酸)和7α-Hydroxy-3-oxo-4-cholestenoate (一种胆汁酸)。
此项研究是第一项探索PFAS暴露与HCC风险之间关系的前瞻性研究。研究发现暴露于高水平的PFOS与非病毒性HCC的风险增加有关;代谢组学确定了几种与PFOS暴露和HCC风险呈正相关的代谢物:PFAS暴露可能通过改变葡萄糖代谢、胆汁酸代谢和支链氨基酸代谢来增加HCC的风险。这些发现可能为环境相关肝病的机制提供新的见解。
此项研究存在一些局限性。首先,50个病例和50个对照的样本量有限,无法检查已知风险因素(如种族、性别或糖尿病状况)对结果的修正;其次,PFAS暴露会随时间而变化,研究只能在一个时间点测量PFAS。然而,PFAS尤其是PFOS的长生物半衰期意味着暴露错误分类的风险很低。
PFAS会永久留在体内,目前仅可通过放血降低体内浓度。对于普通大众而言,饮用水中的PFAS无法通过过滤消除,短期内改变饮用水健康标准也不太现实。我们只有在日常生活中尽量避免使用释放PFAS的物质,如不使用有不粘锅涂层的锅,不使用含有PFAS的化妆品,不选购有包装的食品等。
撰文|文竞择
排版|文竞择
参考资料:
[1]Liu, L., Qu, Y., Huang, J. et al. Per- and polyfluoroalkyl substances (PFASs) in Chinese drinking water: risk assessment and geographical distribution. Environ Sci Eur 33, 6 (2021). https://doi.org/10.1186/s12302-020-00425-3
[2]Jesse A. Douglas W. Xiangping Lin. et al. Exposure to perfluoroalkyl substances and risk of hepatocellular carcinoma in a multiethnic cohort Goodrich, JHEP Reports, DOI:https://doi.org/10.1016/j.jhepr.2022.100550