
从传统的手术、放化疗到当前火热的免疫疗法,科学家们一直试图找到对抗癌症的更好疗法。作为一种新型抗癌途径,肿瘤免疫疗法有着独有的特点——它是一种动态的治疗,更多的是对自身免疫系统的一种“培养和教育”,使之成为攻击肿瘤的“武器”。 目前,全球制药公司已经获批的或者正在积极开发的肿瘤免疫疗法产品包括免疫检查点抑制剂、CAR-T疗法、溶瘤病毒和肿瘤疫苗等。
不过,正如传统抗癌药的研发一样,免疫疗法的开发并不容易。不同于放化疗和靶向治疗的毒性杀伤作用,肿瘤免疫疗法的作用原理是基于免疫系统,因此对其研发及评价方法有着独特的要求。
那么,在开发肿瘤免疫疗法时,究竟应该如何利用动物模型更好地模拟患者的免疫系统?怎样的动物模型才能帮助药企更快、更好地开发出具有竞争力的药物?近日,生物探索就这些问题采访了北京艾德摩生物技术有限公司的联合创始人兼首席执行官彭思颖博士,请她为我们分享该领域的经验和心得。
生物探索:肿瘤免疫疗法临床成功率低的主要原因是什么?
彭思颖:成功率低的原因很大程度上与临床前选择的动物模型有关。常规使用的基因改造动物模型或者基于免疫缺陷动物构建的PDX模型,并不具备人源免疫系统。它们并不能很好地模拟由肿瘤细胞、免疫细胞、间质细胞及这些细胞分泌的细胞因子、驱向因子共同组成的复杂的肿瘤微环境,从而增加了肿瘤免疫疗法研发的难度。所以容易导致其评估结果与临床相关程度相差较远。
生物探索:如何更好地模拟人体内免疫系统以及肿瘤组织的异质性?
彭思颖: 具体来说,我们构建了一种“肿瘤免疫双人源化小鼠”,并以该模型为基础建立肿瘤免疫疗法评价平台——IdealImmune。 该模型的构建过程有两个关键:人源免疫系统的重建和患者来源肿瘤组织的异种移植。我们以自主构建的重度免疫缺陷NPI小鼠为原型,将人的造血干细胞(HSCs)移植到小鼠体内,使其重建人免疫系统并在此基础上移植人源的肿瘤组织,最终获得肿瘤免疫双人源化模型。
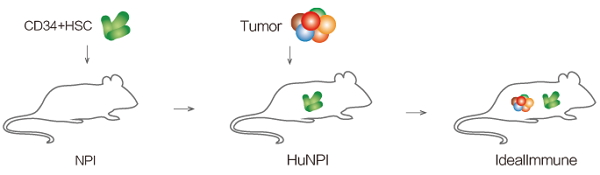
肿瘤免疫双人源化小鼠模型构建流程
这一模型同时具有人的免疫系统以及人源肿瘤组织,能够真实模拟人免疫系统与肿瘤相互作用的过程,可用于临床前评价肿瘤免疫疗法的有效性及安全性。
生物探索:对于当前肿瘤免疫领域的研发热点——免疫检查点抑制剂,IdealImmune如何实现对这类药物的临床前评价?
彭思颖:这几年的研究表明,包括PD-1/PD-L1抗体和CTLA4抗体等在内的检查点抑制剂具有非常卓越的抗癌能力。然而,作为免疫疗法的一种,检查点抑制剂无法在常规的肿瘤疗法的研发及评价平台上进行验证,这意味着我们需要构建一套针对肿瘤免疫疗法特有的临床前评价方法。
为了验证IdealImmune平台是否能够很好地模拟抗癌药物在肿瘤微环境中本应发挥的作用(例如CD8+T细胞的激活、细胞因子的释放等),我们以非小细胞肺癌和胰腺癌为肿瘤模型,使用PD-1抗体药物对小鼠进行治疗。结果显示,相比于对照组,用药组小鼠肿瘤组织中浸润的CD8+T细胞数量明显增加,通过流式分析能够观察到相应免疫检查点被抑制, 而且能够检测到其释放的细胞因子。这意味着,在肿瘤免疫双人源化小鼠模型中,免疫检查点抑制剂能够有效地激活具有杀伤能力的CD8+T细胞。
生物探索:除了PD-1/PD-L1等单抗,双特异性抗体同样受到了一些制药企业的追捧。艾德摩是否有针对这一抗癌“利器”的布局?
彭思颖:双特异性抗体是指含有两种特异性抗原结合位点的人工抗体,这个概念可以追溯至上世纪80年代,但是真正得到临床验证却耗费了30多年时间。全球仅有两款双特异性抗体获批上市——Removab(欧洲上市)和安进公司的Blincyto(在美国和欧洲上市)。目前,该领域在研的双抗药物已超百种,国内包括信达、岸迈等在内的企业都逐渐开始参与双特异性抗体药物的研发。
值得注意的是,双抗研发的技术门槛较高,无论是早期开发、效果评估还是工艺开发、临床研究,每一个节点都比传统抗体复杂。所以,双抗所需要的临床前验证要求自然也高。我们的肿瘤免疫双人源化平台可以为其药效、药代动力学、安全药理、单次给药毒性、重复给药毒性、免疫原性研究等提供很好的数据支持。目前,艾德摩已经与一些企业合作开展双抗试验,希望能够助力打造中国自己的双特异性抗体药物。
生物探索:您如何看待联合治疗?双人源化小鼠模型如何助力?
彭思颖:尽管已经获批的PD-1/PD-L1抗体等免疫疗法挽救了很多患者的生命,但依然有很大一部分患者没能获益于免疫疗法的单一用药。未来,联合治疗将是肿瘤治疗发展的必然趋势之一。根据美国临床试验相关网站信息,当前与PD-1/PD-L1疗法有关的组合疗法研发项目有数百项,且这种研发趋势正在不断上涨。
但是,究竟免疫联合治疗要联合什么?怎样去联合?这都需要大量的临床前研究进行前期探索。通过我们的小鼠模型库,可以大大减少摸索时间和失败率,可以帮助药企确定药物组合、临床方案设计等等。我相信,双人源化小鼠模型可以成为推进联合疗法研发的有力工具。
生物探索:对于CAR-T疗法,IdealImmune平台是否同样能够发挥评价作用?
彭思颖:CAR-T作为另一个热门的免疫疗法方向,在急性血液肿瘤的临床试验中已经取得了显著的疗效,被认为是最有前景的肿瘤治疗方式之一。同时,很多公司和研发团队也在进行CAR-T治疗实体瘤的尝试,并取得了一些初步的成果。
目前,CAR-T的安全性是阻碍其应用的关键障碍,包括细胞因子风暴、脱靶毒性和神经毒性等。我们的IdealImmune平台能够作为患者的替身,帮助临床医生和CAR-T研发人员制定更为优化的治疗方案。
生物探索:除了抗癌药物有效性和安全性的评价之外,IdealImmune平台还可以用在哪些方面?
彭思颖:IdealImmune平台非常值得一提的另一个应用是准临床试验,即利用大量的小鼠模型试验实现临床模拟。一直以来,药企在研发上常常面临投入产出不成正比、患者入组率低、能满足药企要求的患者太少等困境,我们的平台可以改善这些现状。在肿瘤免疫药物有效率不高,不确定哪个药物有用的情况下,我们可以依赖于动物临床试验进行多种尝试。每只小鼠对应一个病例,在小鼠检测药物有效后再进行入组,提高药物研发的成功率。

Clinical Trial
我们还可以进行PDX-match,通过与医院合作,对患者进行随访,以PDX为模型做到与医院的治疗方案同步,进行药物的筛选。在入组前,我们可以借助IdealImmune平台对生物标志物或其他的入组条件进行验证。

PDX-MATCH
最后,回归到免疫疗法的开发上,以PD-1抗体为例,今年5月,PD-1抗体Keytruda获得FDA批准,成为首款不依据肿瘤来源,而依据生物标志物进行区分的抗肿瘤疗法。这是抗癌药历史上的一个里程碑。在此之前,FDA已经批准PD-1抗体用于治疗黑色素瘤、非小细胞肺癌、肾细胞癌、经典型霍奇金淋巴瘤、头颈癌等多种癌症类型。全球大小的制药公司也在积极开发这类免疫疗法的其它适应症,有业内人士将PD-1抗体戏称为“广谱抗癌药”。免疫疗法在抗癌方面的这些“成绩”也直接推动了我们利用双人源化小鼠模型进行更多的尝试,包括筛选指导PD-1抗体等检查点抑制剂治疗的生物标志物以及新的临床适应症。
我们希望,IdealImmune平台能够帮助药企更好、更快地开发更有效的癌症免疫疗法。我们更希望看到,借助我们平台成功开发的药物能够挽救更多癌症患者的生命。







